
【题目】实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行反应热测定。

(1)写出该反应的热化学方程式[生成1mol H2O(l)时的反应热为-57.3 kJ·mol-1]________________________。
(2)取50mLNaOH溶液和30 mL硫酸溶液进行实验。
①实验数据如下表,温度差平均值为_________
温度 次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1.0 g·mL-1,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则生成1 mol H2O(l)时的反应热ΔH=_____(列出计算式即可,单位为kJ·mol-1)。
③上述实验数值结果大于-57.3 kJ·mol-1,产生偏差的原因不可能是_____
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1 4.0℃ ![]() b
b
【解析】
(1)中和热为强酸和强碱的稀溶液发生中和反应生成1molH2O(l)时的焓变,为-57.3 kJ·mol-1,NaOH和硫酸反应的热化学方程式为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l) ΔH=![]() ;答案为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1;
;答案为:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1;
(2)①第2组数据偏差较大,不可靠,应舍去,其他三组的温度差平均值为![]() ,答案为:4.0℃;
,答案为:4.0℃;
②50mL0.50 mol·L-1NaOH溶液和30 mL 0.50 mol·L-1硫酸溶液进行中和反应生成水的物质的量为![]() ,混合溶液的质量为
,混合溶液的质量为![]() ,温度变化的值为ΔT=4.0℃,则生成0.025mol水放出的热量Q=
,温度变化的值为ΔT=4.0℃,则生成0.025mol水放出的热量Q=![]() ,即1.3376kJ,所以实验测得是中和热ΔH=
,即1.3376kJ,所以实验测得是中和热ΔH=![]() ;答案为:
;答案为:![]() ;
;
③a.实验装置保温、隔热效果必须好,否则导致测得的放热值偏小,得到的中和热数值偏小,a项正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的NaOH溶液体积偏大,放出的热量值偏高,则测得中和热的数值偏大,b项错误;
c.尽量一次快速地将NaOH溶液倒入盛有硫酸的小烧杯中,分多次把NaOH溶液倒入盛有硫酸的小烧杯中会导致热量散失,使得测量的温度差偏小。得到的中和热的数值偏小,c项正确;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,酸碱中和放热,使得测得的硫酸的起始温度偏高,温度差偏小,得到的中和热的数值偏小,d项正确;
答案选b。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
(3)下列物质中,可以通过乙烯加成反应得到的是______(填序号)。
a.CH3CH3 b.CH3CHCl2 c.CH3CH2OH d.CH3CH2Br
(4)已知 2CH3CHO+O2![]() 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
![]()
反应②的化学方程式为_________。 工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为_____________,反应类型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结论与实验操作及现象不相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某酸雨样品中加入Ba(OH)2溶液,有白色沉淀生成 | 酸雨试样中一定含SO42- |
B | 向KI-淀粉溶液中滴入氯水,溶液变成蓝色 | I-的还原性强于Cl- |
C | 将Ba(OH)2·8H2O和NH4Cl晶体在小烧杯中混合搅拌,用手触摸烧杯外壁感觉变凉 | Ba(OH)2·8H2O与NH4Cl的反应是吸热反应 |
D | 向某盐溶液中加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口,试纸变蓝 | 该盐溶液中含有NH4+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁与稀硝酸的反应为:Mg+HNO3(稀)——Mg(NO3)2+NO↑+H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目_____________。
(2)该反应中,还原产物是_________,HNO3表现了___________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。还原剂与氧化剂的的物质的量之比为____________。
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是用于制备药品盐酸祛炎痛的中间产物,已知其合成路线如下:
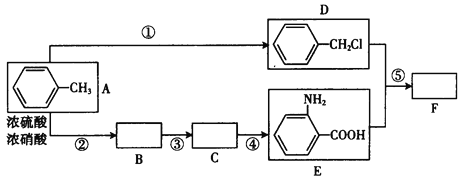
Ⅰ.RNH2+![]() CH2Cl
CH2Cl![]() RNHCH2
RNHCH2![]() +HCl(R和
+HCl(R和![]() 代表烃基)
代表烃基)
Ⅱ.苯的同系物易被高锰酸钾溶液氧化如下:
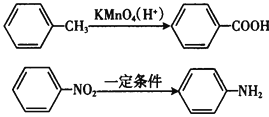
Ⅲ.苯胺具有弱碱性,易氧化。
回答下列问题:
(1)写出反应①的反应物质和条件_____________,B中所含官能团的名称_____________,C的结构简式__________________。
(2)D+E→F的化学方程式:______________。
(3)E的一种同分异构体(对位氨基)在一定条件下,可聚合成热固性很好的功能高分子,写出合成此高聚物的化学方程式__________________。
(4)写出D的含有苯环的同分异构体,已知该核磁共振氢谱图有3种不同类型的氢原子,峰面积之比为3 :2 :2,则该物质是______________(写结构简式)。
(5)反应①~⑤中,属于取代反应的是(填反应序号)________________,反应③的反应类型_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向恒容的密闭容器中充入一定量的NO2(g),发生反应2NO2(g)![]() N2O4(g)△H<0。下列选项中不能作为判断反应是否达到平衡状态的因素的是
N2O4(g)△H<0。下列选项中不能作为判断反应是否达到平衡状态的因素的是
A.混合气体的平均相对分子质量B.NO2(g)的百分含量
C.容器内压强D.NO2和N2O4的反应速率之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式____,将54.8g Na2CO3和NaHCO3 的混合物分成等量的两份,一份溶于水后加入足量盐酸,收集到气体V L,另一份直接加热至恒重,生成气体2.24L(所有气体体积均在标准状况下测定),则原固体混合物中Na2CO3的物质的量:n(Na2CO3)=____,气体V=____。
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为____,若有2mol氯气参与该反应,则此时转移的电子数为____NA。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为____。
(4)长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为____。
(5)葡萄糖(分子式C6H12O6)是人体活细胞的能量来源。已知1mol等于1000mmol,某体检单的一些指标如图,则每升该样品中含葡萄糖的质量为____g(请保留两位小数)。
9 | 白球比 | 1.6 | |
10 | 乳酸脱氢酶 | 161 | U/L |
11 | 磷酸肌酸激酶 | 56 | U/L |
12 | 甘油三酯 | 0.52 | mmol/L |
13 | 总胆固醇 | 4.27 | mmol/L |
14 | 高密度脂蛋白胆固醇 | 1.57 | mmol/L |
15 | 低密度脂蛋白胆固醇 | 1.40 | mmol/L |
16 | 葡萄糖 | 4.94 | mmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
I.五种元素的原子电子层结构如下:A:1s22s22p63s23p63d54s2、B:1s22s22p63s2、C:1s22s22p6、D:1s22s22p63s23p2、E:[Ar]4s1。
请回答:(填元素符号)
(1)________元素是稀有气体。含未成对电子数最多的元素是________。
(2)A元素原子的核外电子共有________种运动状态,能量最高的能级是________(填能级符号)。
(3)D元素原子的价层电子排布图是________。
(4)________元素的电负性最大,________元素原子的第一电离能最大,________元素最可能生成具有催化性质的氧化物。
II.Q、R、X、Y、Z五种元素的原子序数依次递增,除Z以外,其余的均为短周期主族元素。已知:
①Q原子2p能级上有一个空轨道;
②R原子核外L层电子数为奇数;
③X原子2p轨道上只有一对自旋相反的电子;
④Y原子价电子(外围电子)排布msnmpn;
⑤Z原子M层所有轨道全部充满,N层无成对电子,只有1个未成对电子。请回答下列问题:
(5)Z2+的核外电子排布式是________,X元素基态原子的核外电子排布图是____________。
(6)Q与Y分别形成的最简单气态氢化物中,稳定性更强的是________(填化学式)。
(7)Q、R、X、Y三种元素的第一电离能数值由大到小的顺序为________(用元素符号作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
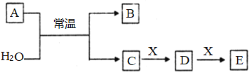
(1)若A为常见的金属单质,且其焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___________________________________________。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为__________(填字母)。
a. NaHCO3 b. Na2CO3 c.Al(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为_______ 。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为___。(填字母)
a.盐酸 b.CaCl2溶液 c.氨水 d.澄清石灰水
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与水反应的化学方程式中氧化剂与还原剂的物质的量之比为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com