

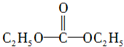 .
. 分析 (1)①正极是氧气得电子生成氢氧化根离子,所以正极区NaOH浓度较大;②负极发生氧化反应;
(2)已知水合肼是二元弱碱(25℃,K1=5×10-7,K2=5×10-15),两步电离都电离产生氢氧根离子,而第一步电离为主;
(3)根据得失电子守恒配平,其中的水合肼是弱电解质用化学式;
(4)①在高温下,N2H4可完全分解为NH3、N2及H2,所以分解反应方程式为:7N2H4$\frac{\underline{\;高温\;}}{\;}$8NH3+3N2+2H2;
②在303K,NiPt催化下,则发生N2H4(l)?N2(g)+2H2(g),设生成氮气的量为xmol,则氢气的量为:2xmol,此时N2H4(l)的物质的量为(1-x)mol,根据4min时比值为3,求出x的值,然后根v=$\frac{△c}{△t}$计算;
(5)C5H10O3分子中有两种氢,且不饱和度为1,所以碳氧双键高度对称.
解答 解:(1)①正极是氧气得电子发生还原反应,正极反应为:O2+2H2O+4e-=4OH-,生成氢氧化根离子,所以正极区NaOH浓度较大,故答案为:正;
②负极发生氧化反应,肼失电子和氢氧根离子反应生成氮气和水,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,故答案为:N2H4+4OH--4e-=4H2O+N2↑;
(2)已知水合肼是二元弱碱(25℃,K1=5×10-7,K2=5×10-15),两步电离都电离产生氢氧根离子,而第一步电离为主,所以离子的浓度大小为:②OH-、③N2H5+、④N2H52+、①H+,故答案为:②③④①;
(3)根据得失电子守恒配平,其中的水合肼是弱电解质用化学式,所以离子方程式为:2Cr2O72-+4H++3N2H4•H2O=4Cr(OH)3↓+3N2+5H2O,
故答案为:2Cr2O72-+4H++3N2H4•H2O=4Cr(OH)3↓+3N2+5H2O;
(4)①在高温下,N2H4可完全分解为NH3、N2及H2,所以分解反应方程式为:7N2H4$\frac{\underline{\;高温\;}}{\;}$8NH3+3N2+2H2,故答案为:7N2H4$\frac{\underline{\;高温\;}}{\;}$8NH3+3N2+2H2;
②在303K,NiPt催化下,则发生N2H4(l)?N2(g)+2H2(g),设生成氮气的量为xmol,则氢气的量为:2xmol,此时N2H4(l)的物质的量为(0.1-x)mol,根据4min时比值为3,所以$\frac{3x}{0.1-x}$=3,则x=0.05mol,v=$\frac{△c}{△t}$=$\frac{0.05mol}{1L×4min}$=0.0125mol•L-1•min-1,故答案为:0.0125mol•L-1•min-1;
(5)C5H10O3分子中有两种氢,且不饱和度为1,所以碳氧双键高度对称,所以结构式为: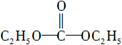 ,故答案为:
,故答案为: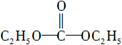 .
.
点评 本题考查电极反应式的书写、离子浓度大小的比较、离子方程式的书写、图象问题等,综合性强,但有一定的难度.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
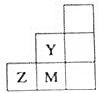
| A. | 非金属性:Y>Z>M | |
| B. | 离子半径:M->Z2->Y- | |
| C. | Z元素存在同素异形现象 | |
| D. | 三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
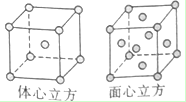 X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍.请回答下列问题:
X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍.请回答下列问题: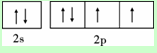 ,其第一电离能在同周期元素中由大到小排第4 位.
,其第一电离能在同周期元素中由大到小排第4 位.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
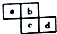
| A. | 原子半径:c>d>a>b | |
| B. | 原子序数d可能是a的3倍 | |
| C. | 最高价含氧酸的酸性c可能比d强 | |
| D. | 四种元素的氢化物可能是18电子分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
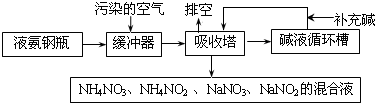
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com