
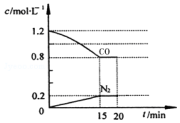
 回答下列问题:
回答下列问题:分析 (1)①根据v=$\frac{△c}{△t}$计算v(N2),根据n=△c×V计算生成N2的物质的量,根据方程式计算参加反应NO物质的量,进而计算NO的转化率;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大;
b.增加CO的量,CO的浓度增大;
c.降低温度,平衡向正反应方向移动;
d.扩大容器体积,压强减小,平衡向逆反应方向移动,平衡时CO浓度减小;
(2)Fe3+在溶液中水解显酸性,通过增大H+浓度的方式抑制Fe3+水解;
(3)根据题目信息“生成可以杀菌消毒的物质”可知一种产物为HClO,根据守恒的原则,另一种产物为NH3.
解答 解:(1)①由图可知,15min N2的浓度变化量为0.2mol/L,则v(N2)=$\frac{0.2mol/L}{15min}$=0.0133mol/(L•min),生成氮气为2L×0.2mol/L=0.4mol,则参加反应的NO为2×0.4mol=0.8mol,故NO的转化率为$\frac{0.8mol}{2mol}$×100%=40.0%,
故答案为:0.0133mol/(L•min);40.0%;
②a.缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大,平衡时CO浓度增大,故a错误;
b.增加CO的量,平衡虽然向正反应方向移动,但CO的转化率减小,到平衡时CO的浓度增大,故b错误;
c.降低温度,平衡向正反应方向移动,到达新平衡时CO的浓度减小,故c正确;
d.扩大容器体积,压强减小,平衡向逆反应方向移动,但CO的物质的量增大程度小于体积增大程度,所以CO浓度减小,
故答案为:cd;
(2)因为Fe3+存在水解平衡:Fe3++3H2O?Fe(OH)3+3H+,水解后溶液显酸性,所以通过增大H+浓度的方式抑制Fe3+水解,
故答案为:存在 Fe3++3H2O Fe(OH)3+3H+,增大H+浓度,平衡逆向移动,抑制FeCl3水解;
(3)根据题目信息“生成可以杀菌消毒的物质”可知一种产物为HClO,根据守恒的原则,另一种产物为NH3,方程式为NH2Cl+H2O=HClO+NH3,
故答案为:NH2Cl+H2O=HClO+NH3.
点评 本题考查化学平衡计算与影响因素、化学反应速率的计算、等效平衡、盐类水解、氧化还原反应等,为高频考点,是对学生综合能力的考查,需要学生具备扎实的基础与灵活应用能力,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 室温,0.1mol•L-1的CH3COOH溶液中:c(CH3COOH)<c(CH3COO-) | |
| B. | 1L 0.1mol•L-1的(NH4)2Fe(SO4)2溶液中:c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | 室温,0.1mol•L-1的CH3COONa、NaOH和Na2CO3三种溶液,pH大小的顺序为:NaOH<CH3COONa<Na2CO3 | |
| D. | 向0.01mol•L-1的NaHSO4溶液中滴加NaOH溶液至中性时:c(SO${\;}_{4}^{2-}$)>c(Na+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为192.9kJ•mol-1 | |
| B. | 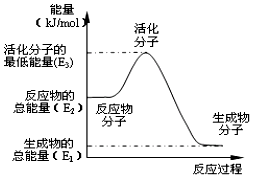 反应①中的能量变化如图所示,且△H1=E2-E1 | |
| C. | 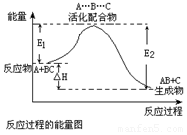 反应②中的能量变化如图所示,且△H2=E2-E1 | |
| D. | 根据②推知反应CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H>-192.9kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
(1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 含义 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
| A. | NH4+-气体法 | B. | I--沉淀法 | ||
| C. | Na+-显色法 | D. | CO32--气体法和沉淀法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g Na2O2与足量水充分反应时电子转移数为2NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 4℃、101.3kPa时,54mL H2O中含有的分子数为3NA | |
| D. | 2L 1mol/L Na2SO4溶液中离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温、常压下,11.2 L N2含有的分子数是0.5NA | |
| B. | 标准状况下,22.4 L水所含水分子数约是NA | |
| C. | 32 g O2在标准状况下的体积约是22.4 L | |
| D. | 1 mol•L-1FeCl3溶液中所含Cl-的数目为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com