
| A. | H3PO4溶于水:H3PO4?3H++PO43- | |
| B. | (NH4)2SO4 溶于水:(NH4)2SO4═2NH4++SO42- | |
| C. | HF溶于水:HF?H++F- | |
| D. | NaHS溶于水:NaHS═Na++HS- HS-?H++S2- |
分析 A.多元弱酸分步电离;
B.硫酸铵为强电解质,完全电离;
C.HF为弱酸,部分电离,用可逆号;
D.硫酸氢钠为强电解质,完全电离产生钠离子和硫氢根离子,硫氢根离子部分电离出氢离子和硫离子.
解答 解:A.磷酸为多元弱酸分步电离,电离方程式:H3PO4?H++H2PO4-,H2PO4-?H++HPO42-,HPO42-?H++PO43-,故A错误;
B.硫酸铵为强电解质,完全电离,电离方程式:(NH4)2SO4 溶于水:(NH4)2SO4═2NH4++SO42-,故B正确;
C.HF为弱酸,部分电离,电离方程式:HF?H++F-,故C正确;
D.硫酸氢钠为强电解质,完全电离产生钠离子和硫氢根离子,电离方程式:NaHS═Na++HS-,硫氢根离子部分电离出氢离子和硫离子,电离方程式:HS-?H++S2-,故D正确;
故选:A.
点评 本题考查了电解质电离方程式的书写,明确电解质类型及电离方式是解题关键,注意电离方程式遵循客观事实、遵循原子个数守恒、电荷守恒规律,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ④>②>③>① | B. | ④>③>②>① | C. | ②>③>①>④ | D. | ③>②>①>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中$\frac{c(C{H}_{3}COO)}{c(C{H}_{3}COOH)•c(OH)}$不变 | |
| C. | 醋酸的电离程度增大,c(H+ )也增大 | |
| D. | 再加入 10mL0.1mol/L 的 NaOH 溶液,混合液的 pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 偏铝酸钠溶液中加入一定量的盐酸,最终一定得到Al(OH)3沉淀 | |
| B. | 钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2 | |
| C. | 向NaOH溶液中通入少量CO2或过量CO2都只生成Na2CO3 | |
| D. | 氯化铝和少量的氨水或过量的氨水反应都得到Al(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
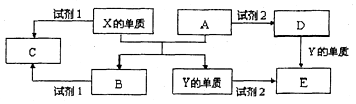 A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com