
【题目】已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。

(1)A的原子序数为26,A元素在周期表中的位置:______,写出NaOH 的电子式:_____。
(2)写出检验D中阳离子的操作方法为_________________________。
(3)保存C溶液时要加固体A的原因是______________。
(4)写出下列转化的方程式:
①B→C的离子方程式:______________________________。
②E→F的化学方程式:_______________________________。
【答案】第四周期第Ⅷ族 ![]() 取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+ 防止Fe2+被O2氧化 Fe3O4 +8H+ = Fe2+ +2 Fe3+ + 4H2O 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+ 防止Fe2+被O2氧化 Fe3O4 +8H+ = Fe2+ +2 Fe3+ + 4H2O 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
【解析】
F是红褐色沉淀,即F为Fe(OH)3,A是一种常见金属,结合框图中物质的转化,从而推知A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,G为Fe2O3,X为H2;
F是红褐色沉淀,即F为Fe(OH)3,A是一种常见金属,结合框图中物质的转化,从而推知A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,G为Fe2O3,X为H2;
(1)A为26号元素,且A为Fe,Fe元素在周期表中的位置:第四周期Ⅷ族;NaOH为离子化合物,含有离子键和共价键,即NaOH电子式为![]() ;
;
(2)D为FeCl3,检验Fe3+常用KSCN,即操作步骤是取D溶液少量于试管中,加入几滴KSCN溶液,溶液变为(血)红色,证明含Fe3+;
(3)C为FeCl2,Fe2+容易被氧化成Fe3+,且2Fe3++Fe=3Fe2+,因此保存FeCl2溶液加铁屑的原因是防止Fe2+被O2氧化;
(4)①Fe3O4与盐酸反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O;
②Fe(OH)2→Fe(OH)3,其化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】下列民俗、诗句、谚语等包含吸热反应的是( )
A.民间焰火之最——确山打铁花B.千锤万凿出深山,烈火焚烧若等闲
C.只要功夫深,铁杵磨成针D.冰,水为之,而寒于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 14gC2H4含有的单键数目为3NA
B. 99℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C. 足量的Na与1molO2充分反应,转移的电子数目一定为2NA
D. 8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,生成物的总能量大于反应物总能量的是( )
A.氢气在氧气中燃烧B.锌和稀硫酸反应制取氢气
C.氧化钙和水的反应D.焦炭在高温下与水蒸气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1]:
2NH3(g) ΔH=-92.4 kJ·mol-1]:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2c1>c3 B. a+b=92.4 C. 2p2<p3 D. α1+α3>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)②c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③c(CH3COO-)=c(Na+)>c(H+)=c(OH-)④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为________(填编号)。
(2)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好反应,则混合前两溶液的物质的量浓度大小关系为c(NaOH)________c(CH3COOH)(填“大于”“小于”或“等于”,下同).
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好是中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH)________c(CH3COOH)(填“大于”“小于”或“等于”),混合后溶液中的各离子浓度的大小关系为_______________________。
(4)25℃时,现有浓度均为0.10 mol·L-1的2种溶液:① 醋酸、② 氢氧化钠。下列说法正确的是______(填字母)。
a.①中有CH3COO-发生水解,促进水的电离
b.②中由水电离出的c(H+)=1.0×10-13 mol·L-1
c.①和②等体积混合后:c(OH-)=c(H+)+c(CH3COOH)
d. ①和②混合后,所得溶液呈中性:c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 羟基与氢氧根离子有相同的化学式和电子式
B. 乙醇的官能团是—OH,可与NaOH溶液发生中和反应
C. 常温下,1 mol乙醇可与足量的Na反应生成11.2 L H2
D. 已知乙醇的结构式如图所示,则乙醇催化氧化时断裂的化学键为①③
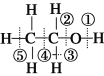
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示,这种有机物可能具有的性质是

①可以燃烧;②能使酸性KMnO4溶液褪色:
③能跟NaOH溶液反应;④能发生酯化反应;
⑤能发生加聚反应
A. ①④B. 全部C. ①②③⑤D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com