
| A. | ①⑤ | B. | ①②⑥ | C. | ②③⑥ | D. | 除④⑦ |
分析 乙烯和氧气发生加成反应生成乙醛,所以该反应的反应类型是加成反应,其中有机反应物发生的反应类型与乙烯相同,说明选项中反应应该是加成反应,据此分析解答.
解答 解:乙烯和氧气发生加成反应生成乙醛,所以该反应的反应类型是加成反应;
①乙醛转化为乙醇,是乙醛和氢气发生加成反应生成乙醇,所以是加成反应,故正确;
②苯酚置于空气中变红是因为苯酚被氧气氧化而导致的,是氧化反应,故错误;
③乙醛的银镜反应为氧化反应,故错误;
④CH3CH2Br在NaOH醇溶液中加热生成乙烯和NaBr、水,为消去反应,故错误;
⑤丙酮(CH3COCH3)与氢气生成2-丙醇,是丙酮和氢气发生加成反应生成2-丙醇,故正确;
⑥甲苯使酸性高锰酸钾溶液褪色是因为酸性高锰酸钾溶液被甲苯还原导致的,发生的是氧化还原反应,故错误;
⑦乙酸乙酯碱性条件下水解为取代反应,故错误;
故选A.
点评 本题以反应类型判断为载体考查有机物结构和性质,为高频考点,明确官能团及其性质关系、基本反应类型概念内涵及其区别是解本题关键,注意:酯的水解反应及酯化反应都属于取代反应.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:实验题
 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ Na+ MnO4- SO42- | B. | Na+ CO32- Mg2+Cl- | ||
| C. | K+Na+ Cl-SO42- | D. | K+ Cl-Ba2+ HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 收集Cl2用排饱和食盐水的方法 | |
| B. | 加催化剂,使SO2和O2 在一定条件下转化为SO3 | |
| C. | 可用浓氨水和NaOH(s)快速制取氨气 | |
| D. | 加压条件下有利于N2和H2反应生成NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向漂白粉稀溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++SO42-+Ba2++4OH-═NH3•H2O+Al(OH)3↓+BaSO4↓ | |
| D. | 酸性溶液中KIO3与KI反应:I-+IO3-+6H+═I2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
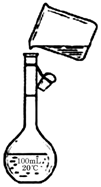
 (1)实验室用如图所示装置制备少量乙酸乙酯.
(1)实验室用如图所示装置制备少量乙酸乙酯.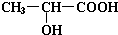 .试回答:
.试回答: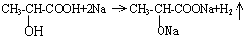 ;
;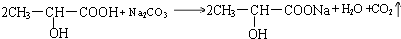 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
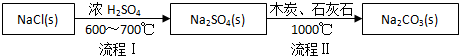
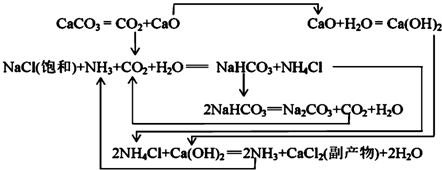
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
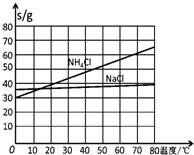
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化,通常表现为热量的变化 | |
| B. | 常温下氢氧化钡晶体与氯化铵晶体混合放出氨气,该反应为放热反应 | |
| C. | 酸碱反应生成1 mol水所发出的热量为中和热 | |
| D. | 旧化学键断裂所放出的能量高于新化学键形成所吸收的能量时发生放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com