
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(NO)/mol•L-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-3 | 1.50×10-3 | 1.50×10-3 |
| c(CO)/mol•L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
分析 (1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
(2)先计算v(NO),再根据反应速率与计量数关系计算v(N2);CO转化率=$\frac{反应的一氧化碳物质的量浓度}{一氧化碳起始浓度}$;
(3)在(NH4)2SO4溶液中存在水解反应,2NH4++H2O?NH3•H2O+H+,往(NH4)2SO4溶液中再加入少量 盐酸抑制水解,水解平衡向逆方向进行,铵根的水解率减小,所以$\frac{c(N{{H}_{4}}^{+})}{c(S{{O}_{4}}^{2-})}$的值将变大;
(4)根据饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀;加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生来分析;
(5)向另一种可溶性钡盐溶液中通入少量SO2气体,会立即看到白色沉淀,说明盐溶液中含有硝酸根离子在酸性溶液中氧化二氧化硫为硫酸,生成硫酸钡沉淀.
解答 解:(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,所以K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(CO){c}^{2}(NO)}$,
故答案为:K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(CO){c}^{2}(NO)}$;
(2)v(NO)=$\frac{(9.5-2.5)×1{0}^{-3}mol/L}{2s}$=3.5×10-3mol/(L•s),再根据反应速率与计量数关系得v(N2)=$\frac{1}{2}$v(NO)=1.75×10-3mol/(L•s);
CO转化率=$\frac{9.0×1{0}^{-3}mol/L-1.0×1{0}^{-3}mol/L}{9.0×1{0}^{-3}mol/L}$×100%=89%,
故答案为:1.75×10-3;89%;
(3)(NH4)2SO4的溶液中铵根离子水解促进水的电离,溶液显酸性,2NH4++H2O?NH3•H2O+H+,往(NH4)2SO4溶液中再加入少量 盐酸,水解平衡向逆方向进行,铵根的水解率减小,$\frac{c(N{{H}_{4}}^{+})}{c(S{{O}_{4}}^{2-})}$将变大,
故答案为:促进;变大;
(4)因为饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀,加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生,
故答案为:饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀,而加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生;
(5)向另一种可溶性钡盐溶液中通入少量SO2气体,会立即看到白色沉淀,说明盐溶液中含有硝酸根离子在酸性溶液中形成稀硝酸具有氧化性,稀硝酸氧化二氧化硫为硫酸,生成硫酸钡沉淀,原可溶性钡盐可能是Ba(NO3)2,
故答案为:BaSO4;Ba(NO3)2.
点评 本题考查化学平衡和反应速率计算、盐类水解、氧化还原反应等知识点,为高频考点,注意盐类水解的实质和把握弱电解质的电离,从影响平衡移动的角度分析水的电离程度,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol苯中含有的碳碳双键数目为0.3 NA | |
| B. | 3.2g臭氧中含有的氧原子数为0.2NA | |
| C. | 1L0.1 mol•L-1 CH3COOH溶液中含有的氢原子数为0.4NA | |
| D. | 标准状况下,22.4 L盐酸中含有的HCl分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量之比为1:1:1 | B. | 体积之比为4:14:13 | ||
| C. | 密度之比为13:13:14 | D. | 原子个数之比为1:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锰价电子排布为3d74s0 | B. | Bi是d区金属 | ||
| C. | 该合金堆积方式是简单立方 | D. | 该晶体的化学式为MnBi |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 连二次硝酸(H2N2O2)是一种二元酸,常温下,用0.01mol•L-1的NaOH溶液滴定10mL0.01mol•L-1 H2N2O2溶液,溶液pH随加入NaOH溶液体积的变化如图所示,下列有关说法中正确的是( )
连二次硝酸(H2N2O2)是一种二元酸,常温下,用0.01mol•L-1的NaOH溶液滴定10mL0.01mol•L-1 H2N2O2溶液,溶液pH随加入NaOH溶液体积的变化如图所示,下列有关说法中正确的是( )| A. | H2N2O2在水溶液中的电离方程式为H2N2O2═2H++N2O22- | |
| B. | 该滴定过程应该选择甲基橙作为指示剂 | |
| C. | a点的溶液中:c(Na+)+c(H+)═c(OH-)+c(N2O22-)+c(H N2O2-) | |
| D. | b点的溶液中:c(Na+)>c(H N2O2-)>c(OH-)>c(H2N2O2)>c(N2O22-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
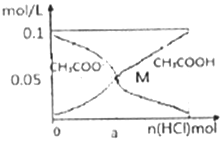 常温下向l0mL0.1mol•L-1CH3COONa溶液中,不断通入HCl气体后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液休积变化),下列说法不正确的是( )
常温下向l0mL0.1mol•L-1CH3COONa溶液中,不断通入HCl气体后,CH3COO-与CH3COOH浓度的变化趋势如图所示(不考虑溶液休积变化),下列说法不正确的是( )| A. | 当n(HCl)=1.0×10-3mol时,溶液中 c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-) | |
| B. | M点溶液中水的电离程度比原溶液小 | |
| C. | 随着HCl的通入,c(OH-)/c(CH3COO-) 值不断减小 | |
| D. | 在M 点时,c(H+)-c(OH-)=(a-0.05)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 原因 | 结论 |
| A | 乙烯和苯都能使溴水褪色 | 苯和乙烯分子都含有碳碳双键 |
| B | 乙酸乙酯和乙烯一定条件下都能和水反应 | 两者属于同一类型的反应 |
| C | 乙酸、葡萄糖都能与新制的氢氧化铜反应 | 都同属于氧化反应 |
| D | 乙烯能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色 | 两者的褪色本质是不相同的 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:ρOH=-lgc(OH-).298K时,向20.00mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示.下列说法正确的是( )
已知:ρOH=-lgc(OH-).298K时,向20.00mL 0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示.下列说法正确的是( )| A. | 曲线PJN表示溶液中pH的变化 | |
| B. | pH与pOH交叉点J对应的V(盐酸)=20.00 mL | |
| C. | M点水的电离程度比Q点大 | |
| D. | M、P两点的数值之和a+b=14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com