
下列化合物:①HCl、②NaOH、③CH3COO H、④NH3•H2O、⑤CH3COONa、⑥NH4Cl
H、④NH3•H2O、⑤CH3COONa、⑥NH4Cl
(1)属于弱电解质的是 ,溶液呈碱性的有 (填序号).
(2)常温下0.01mol/L HCl溶液的pH=2;pH=11的CH3COONa溶液中由水电离产生的c(OH﹣)= .
(3)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m n (填“大于、等于、小于”).
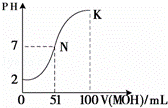
(4)常温下,向100mL 0.01mol•L﹣1HA溶液逐滴加入0.02mol•L﹣1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
①N点对应的溶液中,c(M+) c(A﹣)(填“大于、等于、小于”).
②K点对应的溶液中,c(M+)+c(MOH)= mol•L﹣1.
考点: 强电解质和弱电解质的概念;pH的简单计算;酸碱混合时的定性判断及有关ph的计算.
分析: (1)在水溶液里和熔融状态下只有部分电离的电解质是弱电解质,碱或强碱弱酸盐其溶液都呈碱性;
(2)pH=﹣lgc(H+);醋酸钠促进水电离,根据氢离子浓度结合水的离子积常数计算氢氧根离子浓度;
(3)醋酸是弱电解质,氯化氢是强电解质,醋酸存在电离平衡,氯化氢不存在电离平衡,将等pH的醋酸和盐酸稀释后溶液的pH仍然相等,则醋酸稀释的倍数大于盐酸;
(4)①N点对应的溶液常温下pH=7,说明溶液呈中性,依据电中性原则回答即可;
②根据物料守恒计算.
解答: 解:(1)在水溶液里和熔融状态下只有部分电离的电解质是弱电解质,属于弱电解质的是一水合氨和醋酸,碱或强碱弱酸盐其溶液都呈碱性,氢氧化钠和氨水、醋酸钠溶液都呈碱性,故答案为:③④;②④⑤;
(2)pH=﹣lgc(H+)=﹣lg0.01=2,醋酸钠促进水电离,醋酸钠溶液中氢离子浓度为10﹣11mol/L,根据水的离子积常数知,氢氧根离子浓度等于10﹣3 mol/L,
故答案为:2;10﹣3 mol/L;
(3)醋酸是弱电解质,氯化氢是强电解质,稀释会促进醋酸的电离,若将醋酸和盐酸稀释相同的倍数,醋酸的pH会比盐酸小,因此若要使醋酸和盐酸稀释后溶液的pH仍然相等,则醋酸要稀释的倍数要更大一点才能满足要求,故答案为:小于;
(4)①N点对应的溶液常温下pH=7,说明溶液呈中性,那么c(H+)=c(OH﹣),溶液中存在:c(M+)+c(H+)=c(OH﹣)+c(A﹣),由于c(H+)=c(OH﹣),那么c(M+)=c(A﹣),故答案为:等于;
②K点时,加入的MOH的物质的量=0.02mol•L﹣1×0.1L=0.002mol,混合溶液的体积是0.2L,根据M元素守恒知,c(M+)+c(MOH)= =0.01mol/L,故答案为:0.01.
=0.01mol/L,故答案为:0.01.
点评: 本题考查了弱电解质的电离、酸碱混合溶液定性判断等知识点,根据弱电解质电离特点及酸碱中和反应来分析解答,明确物质的性质是解本题关键,再结合基本概念、pH的计算、物料守恒等知识点分析,题目难度中等.


科目:高中化学 来源: 题型:
Na和Na+两种粒子中,不相同的是( )
①核内质子数 ②核外电子数 ③最外层电子数 ④核外电子层数.
|
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
为探讨反应X+YZ中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间(秒)如右表所示.下列关于该反应反应速率的判断,正确的是()
c(X) c(Y) 所需时间
0.10 0.10 0.60s
0.20 0.10 0.15s
0.20 0.05 0.30s
A. 与c(X)成正比且与c(Y)成正比 B. 与c(X)成正比且与c(Y)无关
C. 与c2(X)成正比且与c(Y)成正比 D. 与c2(X)成正比且与c(Y)成反比
查看答案和解析>>
科目:高中化学 来源: 题型:
用0.1mol/LNaOH溶液滴定0.1mol/L盐酸溶液,如达到滴定终点时不慎多加了1滴NaOH溶液 (1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是()
A. 10 B. 9 C. 11.5 D. 12.5
查看答案和解析>>
科目:高中化学 来源: 题型:
已知Ksp(AgCl)=1.56×10﹣10,Ksp(AgBr)=7.7×10﹣13,Ksp(Ag2CrO4)=9.0×10﹣12.某溶液中含有Cl﹣、Br﹣和CrO42﹣浓度均为0.010mol•L﹣1,向该溶液中逐滴加入0.01 0mol•L﹣1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为()
0mol•L﹣1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为()
A. Cl﹣、Br﹣、CrO42﹣ B. CrO42﹣、Br﹣、Cl﹣
C. Br﹣、Cl﹣、CrO42﹣ D. Br﹣、CrO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关系正确的是( )
A. 沸点:戊烷>2,2﹣二甲基戊烷>2,3﹣二甲基丁烷>丙烷
B. 同物质的量的物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸(C7H6O2)
C. 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯
D. 密度:CCl4>CHCl3>H2O>苯
查看答案和解析>>
科目:高中化学 来源: 题型:
共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:①Na2O2、②SiO2、③NH4Cl、④金刚石、⑤CaH2、⑥白磷,其中含有两种结合力的组合是( )
A. ①③⑤⑥ B. ②④⑥ C. ①③⑥ D. ①②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
请按要求回答下列问题.
(1)根据图1回答①②:
①A电极可观察到的现象是 物质,电极反应式为 ;B极的电极反应式为 .
②通电一段时间后,CuSO4溶液的浓度 ,pH (填“变大”、“变小”或“不变”).
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为 ,电解反应的离子方程式为 .
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积 .

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com