
| A、向水中加入稀氨水,平衡逆向移动,c(H+)降低 |
| B、向水中加入少量固体醋酸钠,c(H+)增大,Kw不变 |
| C、向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低 |
| D、将水加热,Kw增大,pH不变 |


科目:高中化学 来源: 题型:
 W、X、Y、Z四种短周期元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:
W、X、Y、Z四种短周期元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3 | B、2:1 |
| C、3:4 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
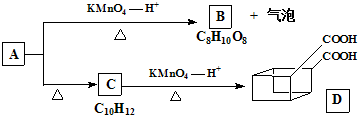
 :
:| 高锰酸钾--氢离子 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
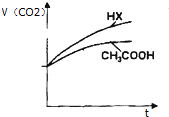 25℃时,将浓度均为0.1mol?L-1 CH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是( )
25℃时,将浓度均为0.1mol?L-1 CH3COOH溶液和HX溶液分别与等浓度的NaHCO3溶液等体积混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,则下列说法正确的是( )| A、电离平衡常数:CH3COOH>HX>H2CO3 |
| B、将pH=2的CH3COOH溶液和HX溶液稀释10倍后,水电离出的c(H+)较大的为HX溶液 |
| C、往10mL 0.1mol?L-1的Na2CO3溶液中缓慢滴加10mL 0.1mol?L-1的HX,混合后的离子浓度大小关系为c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
| D、当浓度均为0.1mol?L-1的CH3COOH溶液和HX的混合液用标准氢氧化钠溶液滴定至中性时,CH3COOH被完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
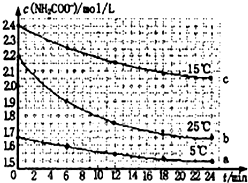 某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.
某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com