
X、Y、Z、W、R属于短周期元素。已知它们都不是稀有气体元素,X的原子半径最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2︰1。 下列叙述错误的是
A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B.Y分别与Z、W、R以两种元素组成的常见化合物有5种
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R> W> Z
D.Y分别与Z、W、R以两种元素组成的常见化合物有5种Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低
科目:高中化学 来源: 题型:
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为
A.1:4 B. 1:2 C. 2:1 D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列各溶液中,离子一定能大量共存的是: ( )
A.pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
B.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.无色溶液中:K+、Na+、MnO4-、SO42-
D.室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y·zH2O。某校化学兴趣小组欲测定其化学式,实验设计如下:
实验Ⅰ:称取一定质量的A,加热分解至恒重。
实验Ⅱ:称取一定质量的A,与足量的酸反应,测量生成CO2气体的质量。
可供选择的仪器和药品如图所示:(酸溶液限选6 mol·L-1盐酸或6 mol·L-1硫酸,其他试剂任选)
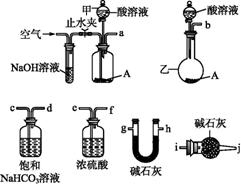
回答下列问题:
(1)仪器乙的名称为 。
(2)请选择必要的装置完成实验Ⅱ,正确的连接顺序为 (按气流方向,用接口字母表示);选用的酸溶液是 。
(3)有人提出不采用实验Ⅰ,可在实验Ⅱ结束后,在A完全反应后所得溶液中滴加足量的氨水,用无灰滤纸过滤,用蒸馏水洗涤反应容器2~3次,将洗涤液过滤,洗涤沉淀2~3次,将附着沉淀的滤纸放到坩埚中加热分解至恒重。判断沉淀已洗涤干净的方法是 ,实际上 未采用该方案的原因是不符合实验设计的 (填字母编号)原则。
未采用该方案的原因是不符合实验设计的 (填字母编号)原则。
A.科 学性 B.安全性
学性 B.安全性
C.可行性 D.简约性
(4)x与y的关系式是 (用等式表示)。
(5)通过实验Ⅰ的相关数据,经计算可得A的摩尔质量为602.0 g·mol-1。实验Ⅱ中称得样品A的质量为9.030 g,与足量酸完全反应后,CO2吸收装置增重0.660 g,则A的化学式为  。
。 
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液与“另一物质”在40~50 ℃时反应可生成它。CuH具有的性质有:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是2Cu+ Cu2++Cu。
Cu2++Cu。
根据以上信 息,结合自己所掌握的化学知识,回答下列问题:
息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液与“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作 (填“氧化剂”或“还原剂”)。
(2)写出CuH在氯气中燃烧的化学反应方程式: 。
(3)CuH溶解在稀盐酸中生成的气体是 (填化学式)。
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
烟道气中的CO2可用于合成甲醇和甲醚。
(1)下图所示为其中的一种方法:
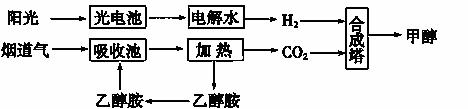
①用光电池电解水时,阳极的电极反应式为__________________________________。
②15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,则HOCH2CH2NH3Cl的水溶液显________(填“酸”“碱”或“中”)性。
③已知,CH3OH(l)+ O2(g)===CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-725.5 kJ·mol-1
H2(g)+ O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l)的热化学方程式为
________________________________________________________________________。
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)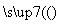 CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是________(填序号)。
a.生成1 mol CH3OCH3(g)的同时,生成3 mol H2O(l)
b.体系中混合气体的密度不随时间而变化
c.体系中CO2与H2的体积比为1∶3
d.体系中的气体的总压强不随时间而变化
②已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比 | 500 K | 600 K | 700 K |
| 1.5 | 45% | 33% | 20% |
| x | a | b | c |
上述反应的化学平衡常数的表达式为__________。该反应的焓变ΔH________0(填“>”、“<”或“=”,下同),若使a>45%,则x________1.5。
③在一定温度下,向体积为0.5 L的密闭容器中加入2 mol CO2和6 mol H2,20 min后达到平衡,测得平衡时CH3OCH3为0.5 mol,则该反应的反应速率v(CO2)=____mol·L-1·min-1,H2的转化率α(H2)=______;加入催化剂,v(CO2)________(填“增大”、“减小”或“不变”,下同),α(H2)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
维生素C的结构简式为
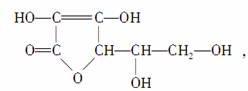 丁香油酚的结构简式为:
丁香油酚的结构简式为:
 下列关于两者的说法正确的是( )
下列关于两者的说法正确的是( )
A.均含酯基 B.均含醇羟基和酚羟基
C.均含碳碳双键 D.均为芳香化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
萘环上的碳原子的编号如(Ⅰ)式,根据系统命名法,(Ⅱ)式可称为2硝基萘,则化合物(Ⅲ)的名称应是( )
 A.2,6二甲基萘 B.1,4二甲基萘
A.2,6二甲基萘 B.1,4二甲基萘
C.4,7二甲基萘 D.1,6二甲基萘
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于各图的叙述正确的是
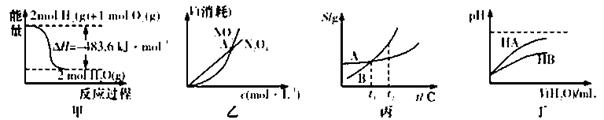
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准然烧热为△H=-241.8 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB浓液的pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com