
【题目】单质钛(Ti)抗腐蚀能力强(放在大海中几周后仍金光闪闪),机械强度高,有“未来金属”之称。又因用它制的“骨头”置入人体后可以在上面长肉,所以又有“亲生物金属”之美誉。工业上常用硫酸分解钛铁矿(FeTiO3,铁为+2价)的方法来制取TiO2,再由TiO2制金属钛。主要反应有:
①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O
②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4
③H2TiO3![]() TiO2+H2O
TiO2+H2O
④TiO2+2C+2Cl2![]() TiCl4↑+2CO↑
TiCl4↑+2CO↑
⑤TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
上述反应中,属于氧化还原反应的有( )
A.①②
B.①⑤
C.③④
D.④⑤
【答案】D
【解析】
有元素化合价变化的反应是氧化还原反应。
①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O反应中,元素化合价都没变,属于非氧化还原反应;
②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4反应中,元素化合价都没变,属于非氧化还原反应;
③H2TiO3![]() TiO2+H2O反应中,元素化合价都没变,属于非氧化还原反应;
TiO2+H2O反应中,元素化合价都没变,属于非氧化还原反应;
④TiO2+2C+2Cl2![]() TiCl4↑+2CO↑反应中,碳元素化合价升高、氯元素化合价降低,有元素化合价变化,属于氧化还原反应;
TiCl4↑+2CO↑反应中,碳元素化合价升高、氯元素化合价降低,有元素化合价变化,属于氧化还原反应;
⑤TiCl4+2Mg![]() 2MgCl2+Ti反应中,镁元素化合价升高、钛元素化合价降低,有元素化合价变化,属于氧化还原反应;
2MgCl2+Ti反应中,镁元素化合价升高、钛元素化合价降低,有元素化合价变化,属于氧化还原反应;
综上所述,④⑤属于氧化还原反应,故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是

A.A为原电池,B为电解池
B.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
C.经过一段时间,B烧杯中溶液的浓度减小
D.将B中右侧石墨改为铜电极,电极上发生的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)通常为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在有机合成中被称为“万能还原剂”。制备硼氢化钠的流程如图:
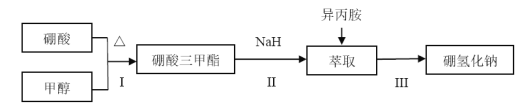
硼酸三甲酯的制备:将硼酸(H3BO3)和适量甲醇加入圆底烧瓶中,然后缓慢地加入浓硫酸,振荡,在烧瓶上加装分馏柱a,用电炉经水浴锅加热,回流2小时,收集硼酸三甲酯与甲醇共沸液。装置如图所示(夹持装置略去,下同)。
硼酸三甲酯B(OCH3)3 | 甲醇 | 甲醇钠 | |
溶解性 | 与乙醇、甲醇混溶,能水解 | 与水混溶 | 溶于甲醇,不溶于异丙胺 |
沸点/℃ | 68 | 64 | 450 |
硼酸三甲酯与甲醇混合物的共沸点为54℃ | |||
(1)直形冷凝管冷却水应从________(填“b”或“c”)接口进入。
(2)浓硫酸的作用是_______。
(3)本实验采用水浴加热,优点是________;U型管中试剂的作用是__________。
(4)在240℃条件下进行,硼酸三甲酯与氢化钠反应制取NaBH4,同时生成CH3ONa,写出该反应的化学方程式______。
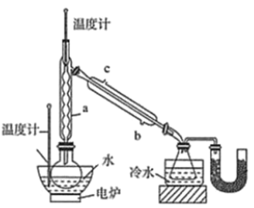
(5)萃取时可采用索氏提取法,其装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现连续萃取。当萃取完全后,硼氢化钠在_______(填“圆底烧瓶”或“索氏提取器”)中。
(6)分离NaBH4并回收溶剂,采用的方法是_______。
(7)“有效氢含量”可用来衡量含氢还原剂的还原能力,定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_____________(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功地在铁掺杂W18O49纳米催化剂表面常温下获得较高的氨产量,反应历程如图所示(★表示被吸附在催化剂表面的物种)。下列说法错误的是
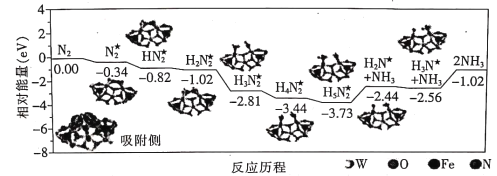
A.需要吸收能量的最大能垒(活化能)E=1.54eV
B.吸收能垒为1.29 eV步骤的反应为H5N2★=NH3+H2N★
C.选择镍掺杂W18O49纳米催化剂获得反应历程与上述不同
D.投料比[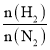 ]越大,单位时间内合成氨的产量越高
]越大,单位时间内合成氨的产量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然油脂的分子式为C57H106O6。1 mol该油脂水解可得到1 mol甘油、1 mol脂肪酸X和2 mol直链脂肪酸Y。经测定X的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。下列说法错误的是( )
A.X的分子式为C18H32O2
B.脂肪酸Y能发生取代反应
C.Y的结构简式可能为CH3CH=CH(CH2)14COOH
D.Y的结构简式为CH3(CH2)16COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为__________洪特规则内容_____________
泡利不相容原理内容______________________
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)__________I1(Cu)(填“大于”或“小于”)。原因是__________
(3)ZnF2具有较高的熔点(872℃ ),其化学键类型是__________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是__________
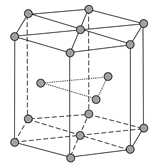
(4)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为__________,配位数为____六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为__________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C-C可以绕键轴旋转,结构简式为下图的烃,下列说法正确的是:
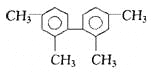
A.分子中至少有9个碳原子处于同一平面上
B.分子中至少有11个碳原子处于同一平面上
C.该烃的一氯取代物最多有3种
D.该烃是苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据如图所示的关系:
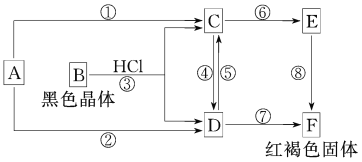
(1)确定A、B、C、D、E、F的化学式:A____________,B____________,C____________,D____________,E____________,F____________。
(2)写出⑧的化学方程式________,④、⑤的离子方程式________,_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com