
【题目】氯及其化合物在生产、生活中有广泛的应用。请按照要求回答下列问题。
I.化合物A在一定条件下通过电解所得产品及其之间的反应如下图所示

(1)写出反应①离子方程式___________________。
(2)溶液G中还应有的溶质化学式为___________________。
II. 以氯酸钠(NaClO3)为原料制备亚氯酸钠(NaClO2)粗品的工艺流程如下图所示:

已知:i.纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;
ii.NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
iii.NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O,等于或高于38℃时析出NaC1O2晶体,高 于60℃时分解成NaClO3和NaCl。
(1)试剂A应选择_______。(填字母)
a.浓硝酸 b. Na2SO3溶液 c. KMnO4溶液
(2)反应②的离子方程式为_______。
(3)已知压强越大,物质的沸点越高。反应②结束后采用“减压蒸发”操作的原因是_____。
(4)反应①进行过程中应持续鼓入空气,其目的是_______。
(5)系列操作依次是_______(写明条件和名称)、过滤、洗涤,最后在________条件下进行干燥,得到粗产品NaClO2。
【答案】 ![]() NaCl b 2OH-+ClO2+H2O2=2ClO2-+O2+2H2O 减压可以使物质沸点降低,实验较低温度下进行蒸发,可避免NaClO2 因温度高而发生分解 稀释ClO2 以防止爆炸 冷却结晶 低于60℃下
NaCl b 2OH-+ClO2+H2O2=2ClO2-+O2+2H2O 减压可以使物质沸点降低,实验较低温度下进行蒸发,可避免NaClO2 因温度高而发生分解 稀释ClO2 以防止爆炸 冷却结晶 低于60℃下
【解析】试题分析:I.B单质焰色呈黄色,B是Na;C是黄绿色气体,C是氯气;所以A是NaCl;电解氯化钠溶液生成氢氧化钠、氢气、氯气,所以D是NaOH、E是H2;根据氧化还原反应升降规律,氯气和氢氧化钠溶液反应生成NaClO3的同时还生成NaCl;II. (1) NaClO3发生还原反应生成ClO2;(2) 反应②是 ClO2、H2O2、NaOH反应生成ClO2-、O2 ;(3) 高于60℃时NaClO2分解成NaClO3和NaCl,需要在较低温度下进行蒸发,减压可以使物质沸点降低;(4) 纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;(5)NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O,等于或高于38℃时析出NaC1O2晶体,高于60℃时分解成NaClO3和NaCl。
解析:I. (1)根据以上分析,反应①是电解氯化钠溶液,离子方程式是![]() ;(2) 根据氧化还原反应升降规律,氯气和氢氧化钠溶液反应生成NaClO3的同时还生成NaCl,所以溶液G中还应有的溶质为NaCl;II. (1) NaClO3发生还原反应生成ClO2,浓硝酸、KMnO4具有氧化性,Na2SO3具有还原性,所以试剂A是Na2SO3,故选b;(2) 反应②是 ClO2、H2O2、NaOH反应生成ClO2-、O2,反应离子方程式是2OH-+ClO2+H2O2=2ClO2-+O2+2H2O;(3) 高于60℃时NaClO2分解成NaClO3和NaCl,减压可以使物质沸点降低,实验较低温度下进行蒸发,可避免NaClO2 因温度高而发生分解;(4) 纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全,持续鼓入空气的目的是稀释ClO2 以防止爆炸;(5)NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O,等于或高于38℃时析出NaC1O2晶体,高于60℃时分解成NaClO3和NaCl,所以系列操作依次是冷却结晶、过滤、洗涤,最后在低于60℃下条件下进行干燥,得到粗产品NaClO2。
;(2) 根据氧化还原反应升降规律,氯气和氢氧化钠溶液反应生成NaClO3的同时还生成NaCl,所以溶液G中还应有的溶质为NaCl;II. (1) NaClO3发生还原反应生成ClO2,浓硝酸、KMnO4具有氧化性,Na2SO3具有还原性,所以试剂A是Na2SO3,故选b;(2) 反应②是 ClO2、H2O2、NaOH反应生成ClO2-、O2,反应离子方程式是2OH-+ClO2+H2O2=2ClO2-+O2+2H2O;(3) 高于60℃时NaClO2分解成NaClO3和NaCl,减压可以使物质沸点降低,实验较低温度下进行蒸发,可避免NaClO2 因温度高而发生分解;(4) 纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全,持续鼓入空气的目的是稀释ClO2 以防止爆炸;(5)NaClO2饱和溶液在温度低于38℃时析出NaClO23H2O,等于或高于38℃时析出NaC1O2晶体,高于60℃时分解成NaClO3和NaCl,所以系列操作依次是冷却结晶、过滤、洗涤,最后在低于60℃下条件下进行干燥,得到粗产品NaClO2。


科目:高中化学 来源: 题型:
【题目】2018年大部分地区爆发了流感流感常伴随发热高烧等症状。布洛芬是一种常用的儿童退热药,它的BHC合成法如下
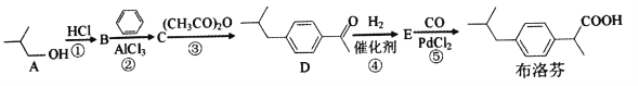
(1)A的名称是__________,B的核磁共振氢谱有__________种吸收峰。
(2)①反应需用浓盐酸而不用稀盐酸,其原因是______________________________。
(3)E的分子式是__________,官能团的名称是__________。
(4)③反应的化学方程式是____________________,反应类型是__________。
(5)满足下列条件的布洛芬的同分异构体有__________种
a遇FeCl3溶液显紫色 b.分子中有5种不同化学环境的氢 c.能发生银镜反应
(6)请写出由苯和( CH3COOCH2CO)2O为原料合成![]() 的线路图(其他试剂任选)___________
的线路图(其他试剂任选)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷的浓硫酸。某兴趣小组的同学发现:将一定量的生铁与浓硫酸加热时,观察到固体能完全溶解,并产生大量气体。为探究反应后的产物,请你协助他们完成相关的实验。
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷的浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是________________________。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要判断溶液X中是否含有Fe2+,应选用________(填序号)。
a.KSCN溶液和氯水 b.K3[Fe(CN)6]溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学将336mL(标准状况)气体Y通入足量溴水中,发现溶液颜色变钱,试用化学方程式解释溴水颜色变浅的原因:__________________________________________________________,然后向反应后的溶液中加入足量BaCl2溶液,经适当操作得干燥固体2.33g。由此推知气体Y中SO2的体积分数为_________。
[探究二]
分析上述实验中SO2体积分数的结果,两同学认为气体Y中还可能含有H2和Q气体。为此设计如图所示探究实验装置(图中夹持仪器省略)。

(3)装置A中发生反应的离子方程式为_____________________,装置B中试剂的作用是____________。
(4)认为气体Y中还含有气体Q的理由是_____________________________(用化学方程式表示)。
为了进一步确认Q的存在,需在装置中添加装置M于_________(填序号),M中所加试剂为_________。
a.A~B之间 b.B~C之间 c.C~D之间 d.E~F之间
(5)利用上述实验装置进一步确认气体Y中是否含有H2,为达到预期的实验目的,加热前称量装置D的总质量为mg,当通入336mL(标准状况)气体Y完全反应后,继续通入氮气至装置D冷却到室温,称量装置D的质量为ng,则原混合气体中H2的体积分数为__________。(用含相关字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知某KNO3溶液A中,混有少量的Ca2+和SO42-等杂质,某同学设计了如下实验方案以制得纯净的KNO3固体。

根据上述回答:
(1)沉淀D中所含有的物质是___.
(2)按上述实验方案制得的KNO3晶体,经分析测定仍含有杂质,其原因是上述第____步(填①、②、③)可能存在问题,请加以完善:________________________________________ 。
Ⅱ.有A、B、C三种可溶性盐,阴、阳离子各不相同,其阴离子的摩尔质量按A、B、C的顺序依次减小。
将等物质的量的A、B、C溶于水,所得溶液中只含有Al3+、Na+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀。请回答下列问题:
(1)经检验,三种正盐中还含有下列选项中的一种离子,该离子是_______。
A.NH4+ B.Ba2+ C.Mg2+ D.Cu2+
(2)写出A的化学式:_________。
(3)若将A、B、C三种盐按一定比例溶于水,所得溶液中只含有Al3+、Cl-、NO3-、Na+四种离子且物质的量之比依次为1:1:3:1(不考虑水电离的影响)。则A、B、C三种盐的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】)蛇纹石矿由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁实验步骤如下:

已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.5 | 3.3 | 9.4 |
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+外,还含有的阳离子有________________。
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见上表),Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀。
(3)物质循环使用,能节约资源,上述实验中,可以循环使用的物质是______________。
(4)高温煅烧碱式碳酸镁aMgCO3·bMg(OH)2·cH2O得到MgO。取碱式碳酸镁4.66 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,通过计算确定碱式碳酸镁的化学式为 ____________________。(写出计算过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )

A. 1--5对应的结构中所有原子均可能处于同一平面的有1个
B. 1--5对应的结构均能使溴的四氯化碳溶液褪色
C. 1--5对应的结构中的一氯取代物只有1种的有3个
D. 1--5对应的结构均不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下:
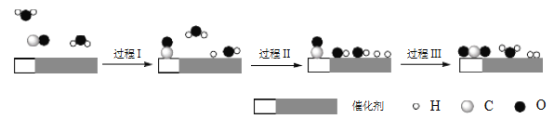
下列说法正确的是
A. 过程Ⅰ、过程Ⅲ均为放热过程
B. 过程Ⅲ生成了具有极性共价键的H2、CO2
C. 使用催化剂降低了水煤气变换反应的ΔH
D. 图示过程中的H2O均参与了反应过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com