



 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源:不详 题型:填空题
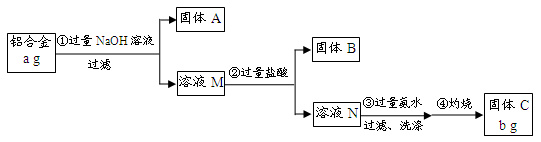
| A.第①步中加入NaOH溶液不足 | B.第②步中加入盐酸不足时 |
| C.第③步中沉淀未用蒸馏水洗涤 | D.第④步对沉淀灼烧不充分 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.晶体硅熔点高硬度大,可用于制作半导体材料 |
| B.氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
| C.漂白粉在空气中不稳定,可用于漂白纸张 |
| D.氧化铁能与酸反应,可用于制作红色涂料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.明矾常做净水剂 |
| B.与铜质水龙头连接处的钢质水管易发生腐蚀 |
| C.发酵粉中含有较多的NaHCO3,能使焙制出的糕点疏松多孔 |
| D.金属钠、金属镁等活泼金属着火时,可以使用泡沫灭火器来灭火 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝热法炼铁:Fe2O3 + 2Al 高温 Al2O3 + 2Fe |
| B.工业上用NH3制备NO:4NH3 + 5O2高温 4NO + 6H2O |
| C.向受酸雨影响的湖泊中喷洒CaCO3粉末:CO32- + 2H+催化剂 H2O + CO2↑ |
| D.过氧化钠用于呼吸面具中作为氧气的来源:2Na2O2 + 2CO2 ==2Na2CO3 + O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.①③④ | D.①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com