
下列说法不正确的是
A.盛有被KCl饱和 溶液浸泡过的琼脂的U型管,可用作原电池的盐桥
溶液浸泡过的琼脂的U型管,可用作原电池的盐桥
B.Al3+能水解为Al(OH)3胶体,明矾可用作净水剂
C.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
D.甲醛能使蛋白质变性,可用作食品防腐剂
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
将0.2mol某饱和一元醇完全燃烧后,生成的气体缓慢通过盛有0.5L 2mol/L的氢氧化钠溶液中,生成两种钠盐Na2CO3 与 NaHCO3的物质的量之比为1:3,
(1)求该一元醇的分子式。 (2)该醇有几种结构中含羟基的同分异构体。
(3)写出(2)中能被氧化为醛的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学——选修3物质结构与性质】
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
⑴X元素在周期表中的位置是 ,属于 区元素,它的外围电子的电子排布图为 。


⑵XZ2分子的立体结构是 ,YZ2分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
⑶含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其原因是 。
⑷元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,则a位置与b位置之间的距离为_______pm(只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下将0.1 mol N2和0.3 mol H2置于密闭容器中发生反应N2+3H2 2NH3。下列关于该反应的说法正确的是( )
2NH3。下列关于该反应的说法正确的是( )
A.最终可生成0.2 mol NH3 B.使用催化剂不影响反应速率
C.增大压强反应速率减小 D.升高温度反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、生产、生活密切相关。下列说法正确的是
A.聚氯乙烯塑料制品可用于食品包装
B.“地沟油”禁止食用,但可以用来制肥皂
C.煤经过气化和液化等物理变化可转化为清洁燃料
D.纤维素、油脂、蛋白质均是天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
香茅醛是一种食用香精,异蒲勒醇是一种增香剂,一定条件下,香茅醛可转化为异蒲勒醇。下列说法不正确的是
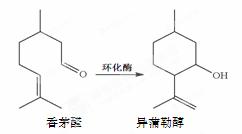
A.香茅醛与异蒲勒醇互为同分异构体
B.香茅醛的分子式为C10H19O
C.异蒲勒醇可发生加成、取代、消去反应
D.鉴别香茅醛与异蒲勒醇可用Br2水
查看答案和解析>>
科目:高中化学 来源: 题型:
以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。
Ⅰ、制取氯化锌主要工艺如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为
1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Zn2+ | 5. 2 | 6. 4 |
| Fe2+ | 5. 8 | 8. 8 |
(1)加入H2O2溶液发生反应的离子方程式为 ▲ 。
(2)流程图中,为了降低溶液的酸度,试剂X可以是 ▲ (选填序号:a.ZnO;b.Zn(OH)2 ; c.Zn2(OH)2CO3 ;d.ZnSO4);pH应调整到 ▲ 。
(3)氯化锌能催化乳酸( )生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ▲ ,聚乳酸的结构简式为 ▲ 。
)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ▲ ,聚乳酸的结构简式为 ▲ 。
Ⅱ、制取金属锌采用碱溶解{ZnO(s)+2NaOH(aq)+H2O(l)=Na2[Zn(OH)4](aq)},然后电解浸取液。
(4)以石墨作电极电解时,阳极产生的气体为 ▲ ;阴极的电极反应为 ▲ 。
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为
A.0.50mol/L B.0.60mol/L C.0.45mol/L D.0.55mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
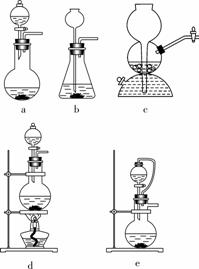
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,图中可选用的发生装置是 ae (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36 L(标准状况)二氧化硫,至少需要称取亚硫酸钠 18.9 g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠 19.8 g (保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为SO2+Ca(OH)2===CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O===2CaSO4·2H2O。其流程如下图:
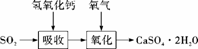
碱法的吸收反应为SO2+2NaOH===Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.90 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 利用SO2是酸性氧化物,可与碱反应 。和碱法相比,石灰-石膏法的优点是 原料易得,吸收成本低 ,缺点是 吸收速率慢,效率低 。21·世纪*教育网
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com