
用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
① → 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
初始读数(mL) | 0.40 | 0.10 | 0.90 | 0.00 |
最终读数(mL) | 25.05 | 20.10 | 21.00 | 19.90 |
V标(mL) | 24.65 | 20.00 | 20.10 | 19.90 |
III、实验数据处理:略
请回答下列问题:
(1)将步骤I中的操作补充完整:
①__________________________ ②__________________________
(2)KMnO4(H+)溶液应装入________式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_____________________________________;判断已达滴定终点的现象是:_____________________________________;
(4)该滴定反应的离子方程式为:__________________________________________;
(5)实验测得草酸溶液的浓度为_____________mol/L;
(6)下列操作会引起实验结果偏高的是_____________
A.向锥形瓶中加入了较多 MnSO4溶液
B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数
(1)①查漏 ; ②排除滴定管尖嘴处的气泡 (各1分)
(2) 酸 (1分)
(3)作反应催化剂,加快KMnO4氧化H2C2O4的速率;
溶液由无色变为(紫)红色,半分钟不褪色 (各2分)
(4) 2MnO4— + 5H2C2O4 + 6H+ == 2Mn2+ + 10CO2 ↑+ 8H2O(2分)
(5) 0.25(2分)
(6) CD(2分)
【解析】
试题分析:(1)滴定过程中首先要检查装置的气密性,向滴定管中注入液体时要至0刻度上方,让后迅速放液,至0刻度下方,目的赶走滴定管尖嘴处气泡,故答案为①查漏 ; ②排除滴定管尖嘴处的气泡 ;
碱性溶液用碱式滴定管,酸性、氧化性溶液用酸式滴定管,故高锰酸钾用酸式滴定管,
(3)向锥形瓶中滴加MnSO4溶液的作用是作反应催化剂,加快KMnO4氧化H2C2O4的速率;达到滴定终点时,高猛酸根离子恰好完全反应生成锰离子,溶液由无色变为(紫)红色,半分钟不褪色,故答案为作反应催化剂,加快KMnO4氧化H2C2O4的速率;溶液由无色变为(紫)红色,半分钟不褪色(4)高锰酸根具有强氧化性,将草酸氧化成二氧化碳,该滴定反应的离子方程式为: 2MnO4— + 5H2C2O4 + 6H+ ==2Mn2+ + 10CO2 ↑+ 8H2O,答案为 2MnO4— + 5H2C2O4 + 6H+ == 2Mn2+ + 10CO2 ↑+ 8H2O
(5)由离子方程式得2MnO4— + 5H2C2O4 + 6H+ == 2Mn2+ + 10CO2 ↑+ 8H2O
2 5
0.1mol/Lx0.019L 0.02Lxc(H2C2O4)
c(H2C2O4)=0.25mol/L,故答案为0.25mol/L
(6)A.向锥形瓶中加入了较多 MnSO4溶液,对结果没有影响;B.锥形瓶中液体溅出,草酸的物质的量减小,消耗的高锰酸钾的体积偏小,故测量的草酸浓度偏低;C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗,即消耗的高锰酸钾的体积偏大,草酸浓度偏大;D.滴定结束时,仰视读数,消耗高锰酸钾的体积偏大,草酸浓度偏大,


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源:2014-2015学年福建省四地六校高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关物理量相应的单位,表达不正确的是
A.摩尔质量:g·mol-1B.密度:g·mL-1
C.气体摩尔体积:L D.阿伏加德罗常数:mol -1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一9月月考化学试卷(解析版) 题型:选择题
在化学学科中,经常使用下列物理量,其中跟阿伏加德罗常数(NA)均无关的组合是( )
①摩尔质量(M)②相对原子质量(Mr)③物质的量(n)④原子半径(r)⑤溶质的质量分数(W)⑥溶解度(S)⑦气体摩尔体积(Vm)
A.①③⑥⑦ B.②④⑤⑥ C.①②③⑤ D.②③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省宝鸡市岐山县高一上学期期中质量检测化学试卷(解析版) 题型:选择题
某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中
A.可能有SO42- 或Ag+ B.一定有SO42-
C.一定无Ag+ D.还可能有CO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省宝鸡市岐山县高一上学期期中质量检测化学试卷(解析版) 题型:选择题
下列常用实验仪器中,能直接加热的是
A.试管 B.普通漏斗
C.蒸馏烧瓶 D.分液漏斗
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期9月培优复习化学试卷(解析版) 题型:选择题
下列实验过程中曲线变化正确的是( )
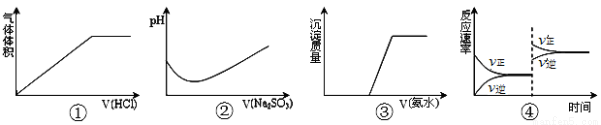
A.①表示Na2CO3溶液中滴入稀盐酸
B.②表示溴水中滴入Na2SO3溶液
C.③表示AgNO3溶液中滴入氨水
D.④表示一定条件下2SO2+O2 2SO3 △H<0达平衡后,升高温度
2SO3 △H<0达平衡后,升高温度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期9月培优复习化学试卷(解析版) 题型:选择题
下列与平衡移动无关的是( )
A.向0.1 mol/L的CH3COOH中加水稀释,溶液pH增大
B.向氯水中投入AgNO3,最终溶液酸性增强
C.夏天,打开冰镇啤酒的盖子后,有大量的气泡冒出
D.在滴有酚酞的Na2CO3溶液中,慢慢滴入BaCl2溶液,溶液的红色逐渐褪去
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高二上学期10月月考化学试卷(解析版) 题型:选择题
已知反应:①101 kPa时,2H2(g)+O2(g) ==2H2O(g)  H=-483.6kJ/mol
H=-483.6kJ/mol
②稀溶液中,H+(aq)+OH-(aq)==H2O(l)  H=-57.3 kJ/mol
H=-57.3 kJ/mol
又知由H2和O2两种气体反应生成1 mol液态水比生成1mol气态水多放出44kJ热量。下列结论中正确的是
A.H2的燃烧热为285.8 kJ/mol
B.H2和O2反应生成液态水时的热化学方程式为H2(g) +1/2O2(g)=H2O(l) △H=-571.6 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省五校协作体高二上学期期中化学试卷(解析版) 题型:填空题
(12分)N2(g)+3H2(g)  2NH3(g)反应过程的能量变化如下图所示。
2NH3(g)反应过程的能量变化如下图所示。

已知生成1 mol NH3(g)的ΔH=-46 kJ·mol-1。请回答下列问题:
(1)图中A、C分别表示 、 ;若该反应使用催化剂,会使图中B点升高还是降低? 。
(2)图中ΔH= kJ·mol-1。
(3)已知恒容时,该体系中各物质浓度随时间变化的曲线如图所示。

①在0.5 L容器中发生反应,前20 min内,v(NH3)=________,放出的热量为________。
②45 min时采取的措施是_______________________。
③比较I、II、III时段的化学平衡常数(分别用K1、K2、K3表示)大小________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com