
【题目】已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。

请回答:
(1)工业上制C用A不用H的原因 。
(2)写出C与K反应的化学方程式 ,该反应的反应物总能量 (填“大于”或“小于”)生成物总能量。
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 。
(4)写出E物质的电子式 。
(5)J与H反应的离子方程式为 。
(6)写出G与熟石灰反应制取漂白粉的化学方程式 。
【答案】(1)氯化铝是共价化合物,熔融状态下不导电;
(2)2Al+Fe2O3![]() Al2O3+2Fe; 大于;
Al2O3+2Fe; 大于;
(3)2KCl+2H2O![]() 2KOH+H2↑+Cl2↑;
2KOH+H2↑+Cl2↑;
(4)![]() ;
;
(5)Al3++3AlO2-+6H2O=4Al(OH)3↓;
(6)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
【解析】试题分析:D的元素的原子最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,则D为O2,K为红棕色固体粉末,应为Fe2O3,由于电解A得到C与D,则C与K生成A的反应为铝热反应,故A为Al2O3,L为Fe,C为Al,黄绿色气体G为Cl2,与C反应得到H为AlCl3,B的焰色反应呈紫色(透过蓝色钴玻璃),含有K元素,B在二氧化锰加热条件下反应生成氧气,则B为KClO3,E为KCl,电解可生成KOH、H2和Cl2,过量的F与氯化铝反应得到J,则I为H2,F为KOH,J为KAlO2,
(1)氯化铝是共价化合物,熔融状态下不导电,故工业上制Al用氧化铝不用氯化铝,故答案为:氯化铝是共价化合物,熔融状态下不导电;
(2)C与K反应的化学方程式为:2Al+Fe2O![]() 3Al2O3+2Fe,该反应为放热反应,故该反应的反应物总能量大于生成物总能量,故答案为:2Al+Fe2O3
3Al2O3+2Fe,该反应为放热反应,故该反应的反应物总能量大于生成物总能量,故答案为:2Al+Fe2O3![]() Al2O3+2Fe;大于;
Al2O3+2Fe;大于;
(3)Fe是目前应用最广泛的金属,用碳棒作阳极,Fe作阴极,接通电源(短时间)电解KCl水溶液的化学方程式为:2KCl+2H2O![]() 2KOH+H2↑+Cl2↑,故答案为:2KCl+2H2O
2KOH+H2↑+Cl2↑,故答案为:2KCl+2H2O![]() 2KOH+H2↑+Cl2↑;
2KOH+H2↑+Cl2↑;
(4)E为KCl,E物质的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)J与H反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(6)G为Cl2,G与熟石灰反应制取漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】(多选)下列各组中的离子,能在溶液中大量共存的是( )
A.Cu2+、H+、Cl﹣、SO42﹣
B.Na+、Fe3+、SO42﹣、OH﹣
C.H+、Na+、CO32﹣、NO32﹣
D.K+、Na+、Cl﹣、OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如下:
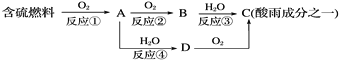
回答下列问题:
①酸雨的pH________(填“>”、“<”或“=”)5.6。
②D物质的化学式为____________。
③反应②的化学方程式为_________________________________________。
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:__________________,反应中氧化剂是____________,还原剂是_______________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O,2NO2+2NaOH===NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收n molNO2和m molNO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________ mol·L1。
②若所得溶液中c(NO3—)∶c(NO2—)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=______。
③用含n和m的代数式表示所得溶液中NO3—和NO2—浓度的比值c(NO3—)∶c(NO2—)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题.
(1)常温下,浓度均为 0.1molL﹣1 的下列五种钠盐溶液的 pH 如表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是 ,根据表中数据,浓度均为0.01molL﹣1 的下列四种酸的溶液分别稀释 100倍,pH变化最大的是 (填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100ml 0.1mol/L NaHCO3②100ml 0.1mol/L Na2CO3 两种溶液:
溶液中水电离出的OH-个数:① ②(填“>”、“=”或“<”,下同).
溶液中阴离子的物质的量浓度之和:① ②.
(3)NaCN遇水可产生易燃的HCN气体,浓度均为0.1mol/L的NaCN和HCN的混合液中滴加酚酞,溶液变红,则混合液中各离子的浓度大小关系为_______________________。
(4)研究证实,CO2可在酸性水溶液中通过电解生成甲醇(CH3OH),则生成甲醇的反应发生在 (填阴极或阳极),该电极反应式是 。
(5)已知Ksp(CuS)=1.3×10-36,Ksp(NiS)=1.0×10-24;在含Cu2+,Ni2+的溶液中,当Ni2+恰好完全沉淀[此时溶液中c(Ni2+)=1.0×10-5 mol·L-1],溶液中Cu2+的浓度是_____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.液态HCl不能导电,所以HCl是非电解质
B.酸性氧化物一定是非金属氧化物
C.在水溶液中能电离产生H+的化合物不一定是酸
D.盐、碱一定含有金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下:

(1)Co2+基态核外电子排布式为________。
(2)NH2OH分子中氮原子轨道的杂化类型是_______,lmolNH2OH分子中含有σ键的数目为_______。
(3)N、H、O三种元素的电负性由小到大的顺序为_________。
(4)ClO4-的空间构型为__________。
(5)一种铁、碳形成的间隙化合物的晶体结构如右图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.15mol/L,c(Cl﹣)=0.2mol/L,则c(NO3﹣)为( )
A.0.05 mol/L
B.0.20 mol/L
C.0.30 mol/L
D.0.40 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氯乙烯简称PVC,是当今世界上产量最大、应用最广的热塑性塑料之一。
(1)工业上以乙烯和氯气为原料合成PVC的流程如下:
乙烯![]() 1,2-二氯乙烷(CH2ClCH2Cl)
1,2-二氯乙烷(CH2ClCH2Cl)![]() 氯乙烯(CH2=CHCl)
氯乙烯(CH2=CHCl)![]() PVC
PVC
①氯乙烯的分子式为____。
②乙烯生成1,2-二氯乙烷的反应类型是____。
③氯乙烯生成PVC的化学方程式为____。
(2)下列有关PVC的说法正确的是___(填字母)。
A.PVC的单体是CH3CH2Cl
B.PVC是高分子化合物
C.PVC能够使溴的四氯化碳溶液褪色
D.PVC易降解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碳酸钠和碳酸氢钠的叙述,正确的是( )
A.常温时,在水中的溶解性:碳酸钠>碳酸氢钠
B.热稳定性:碳酸钠<碳酸氢钠
C.质量相同时,分别与同体积同浓度盐酸反应的快慢:碳酸钠>碳酸氢钠
D.物质的量相同时,分别与足量的盐酸反应,生成CO2的质量:碳酸钠<碳酸氢钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com