
(14分)近年来雾霾天气多次肆虐我国部分地区。其中燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 。在密闭容器
2CO2(g)+ N2(g) 。在密闭容器
中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图1所示。据此判断:
①该反应的△H 0(填“<”或“>”)。
②在T2温度下,0~2s内的平均反应速率v (N2)为 。
③若该反应在绝热、恒容的密闭体系中进行,下列图2中正确且能说明反应在进行到t1时刻达到平衡状态的是 (填字母编号)。

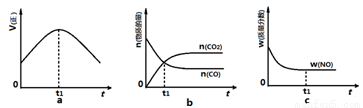
图1 图2
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气中含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g) N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1 mol/L食盐
水的装置,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。

①该燃料电池的负极反应式为 。
②电解后溶液的pH约为 (忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下约为 L。
(14分)(每空2分)(1)①< ②0.025mol/(L·s) ③c
(2)N2O4(g)+CH4(g)=N2(g)+2H2O(l)+CO2(g) △H=-898.1kJ/mol
(3)①CH4-8e-+2H2O= CO2+8 H+ ②14 ③1.68
【解析】
试题分析:(1)①根据化学平衡中“先拐先平”的规律,T1>T2,则温度升高,二氧化碳浓度减小,说明升温平衡逆向移动,所以正向是放热反应△H<0;
②2s内二氧化碳的浓度增加0.1mol/L,则氮气的浓度增加0.05mol/L,所以v (N2)=0.05mol/L/2s=0.025mol/(L·s);
③图a中t1时刻说明正反应速率最大,因为该反应为放热反应,容器为绝热容器,所以开始时相当于给体系升温,温度升高,反应速率加快,但同时升温不利于正反应的进行,所以正反应速率后来又逐渐减小,当正反应速率不再变化时说明达平衡状态,因此t1时刻未达到平衡状态;b图中t1时刻的一氧化碳和二氧化碳的物质的量相等,不能说明t1时刻达到平衡状态;c图中t1时刻NO的质量分数不再变化,说明已达平衡状态,正确,答案选c。
(2)根据盖斯定律,目标方程式=①-②+2×③,所以CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式为N2O4(g)+CH4(g)=N2(g)+2H2O(l)+CO2(g) △H=-898.1kJ/mol
(3)①燃料电池中的负极是燃料发生氧化反应,所以该燃料电池的负极反应式为CH4-8e-+2H2O= CO2+8 H+
②食盐水中的Cl-的物质的量是0.1mol,若按电解食盐水的化学方程式中2NaOH~H2~Cl2,当生成0.1mol氢气时,应生成0.1mol氯气,与题意不符,所以电解食盐水开始是Cl-和H+放电,Cl-放电完毕后是OH-放电,因此溶液中氢氧化钠的物质的量为0.05mol×2=0.1mol,所以c(OH-)=0.1mol/0.1L=1mol/L,溶液pH=14;
③根据②的分析,阳极产生0.05mol的氯气和0.025mol的氧气,所以标准状况下的体积是1.68L。
考点:考查化学平衡理论的应用,热化学方程式的计算及书写,电化学理论的应用


科目:高中化学 来源:2013-2014重庆市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列反应属于吸热反应的是( )
A.碳与水蒸气制水煤气的反应
B.生石灰和水的反应
C.盐酸与氢氧化钠溶液的反应
D.木炭在氧气中燃烧
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市名校联盟高三三诊理综化学试卷(解析版) 题型:选择题
在一定条件下,将E(g)和F(g)充入体积不变的2 L密闭容器中,发生下述反应,并于5 min末达到平衡:2E(g)+F(g) 2G(g)。有关数据如下:
2G(g)。有关数据如下:
| E(g) | F(g) | G(g) |
初始浓度(mol?L-1) | 2.0 | 1.0 | 0 |
平衡浓度(mol?L-1) | c1 | c2 | 0.4 |
下列判断正确的是
A.反应在前5min内,v(E)=0.04 mol/(L·min)
B.其他条件不变,若增大E的浓度,则达平衡时E的转化率会增大
C.其他条件不变,降低温度,平衡时n(E)=3.0mol,则反应的△H>0
D.平衡后移走2.0 mol E和1.0 mol F,在相同条件下再达平衡时,c(G)<0.2 mol?L-1
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:选择题
下列说法错误的是;
A.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2
B.硅酸盐NaAlSiO4·nH2O可改写成氧化物形式为:Na2O·Al2O3·2SiO2·2nH2O
C.Al65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属Al、Cu、Fe都大
D.过量铁与浓硫酸加热反应可以得到氢气
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市六校高三5月第三次诊断性考试理综化学试卷(解析版) 题型:选择题
雌二醇和炔雌醇是两种雌激素用药,它们的结构简式如下,关于它们的说法不正确的是

A.核磁共振氢谱峰数相同
B.均能发生加成反应、取代反应、消去反应
C.两种分子中所有碳原子不可能在同一个平面内
D.可用FeCl3溶液鉴别
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市主城七区高三下学期第二次联考理综化学试卷(解析版) 题型:选择题
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种遗传病。其转化过程如下:

下列说法错误的是
A.酪氨酸的分子式为C9H11O3N
B.对羟苯丙酮酸分子中有三种含氧官能团
C.可用溴水鉴别对羟苯丙酮酸与尿黑酸
D.1 mol尿黑酸最多可与含3 mol NaOH的溶液反应
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:简答题
(13分)有机物A有如下转化关系,在A的质谱图中质荷比最大值为88,其分子中C、H、O三种元素的质量比为6:1:4且A不能使Br2的CCl4溶液褪色;1molB反应生成了2molC.

请回答下列问题:
(1)C→E的反应类型为____________
(2)若①、②、③三步反应的产率分别为93.0%、81.0%、88.0%,则由A合成H的总产率为____________
(3)A的结构简式为___________________·
(4)写出C与银氨溶液反应的离子方程式为____________________________________
(5)H分子中所有碳原子均在一条直线上,G转化为H的化学方程式为__________________
(6)X是A的一种同分异构体,且其核磁共振氢谱有3个峰,峰面积之比为1:1:2,1mol X可在HIO4加热的条件下反应,产物只有1mol Y,则X的结构简式为____________
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:实验题
(13分)醋酸亚铬水合物([Cr(CH3COO)2)]2·2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸。实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:

Zn(s) + 2HCl(aq) = ZnCl2(aq) + H2(g)
2CrCl3(aq) + Zn(s)= 2CrCl2 (aq) + ZnCl2(aq)
2Cr2+(aq) + 4CH3COO-(aq) + 2H2O(l) = [Cr(CH3COO)2]2·2H2O (s)
请回答下列问题:
(1)检查虚框内装置气密性的方法是 。
(2)醋酸钠溶液应放在装置 中(填写装置编号,下同);盐酸应放在装置 中;
装置4的作用是 。
(3)本实验中所有配制溶液的水需煮沸,其原因是 。
(4)将生成的CrCl2溶液与CH3COONa溶液混合时的操作是 阀门A、 阀门B (填“打开”或“关闭”)。
(5)本实验中锌粒须过量,其原因是 。
(6)为洗涤[Cr(CH3COO)2)]2·2H2O产品,下列方法中最适合的是 。
A.先用盐酸洗,后用冷水洗 B.先用冷水洗,后用乙醇洗
C.先用冷水洗,后用乙醚洗 D.先用乙醇洗涤,后用乙醚洗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com