


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
| A、反应中氧化剂与还原剂的物质的量比值为3:2 |
| B、反应中NaOH既不是氧化剂也不是还原剂 |
| C、当有0.2mol Fe(OH)3参加反应时转移的电子数目为1.204×1023 |
| D、反应中NaClO被还原,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加水,将湿润的红色石蕊试纸放在试管口 |
| B、加NaOH溶液,加热,将湿润的红色石蕊试纸放在试管口 |
| C、加NaOH溶液,加热,滴入酚酞试剂 |
| D、加NaOH溶液,加热,滴入紫色石蕊试剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
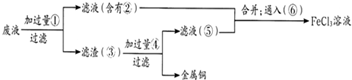
 )是一种典型的金属有机化合物,实验室常用新制氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O.二茂铁的熔点为172~173℃,在100℃开始升华.能溶于乙醚、二甲亚砜等溶剂,不溶于水,对碱和非氧化性酸稳定.某研究小组设计的实验方案和制备装置示意图如下:
)是一种典型的金属有机化合物,实验室常用新制氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O.二茂铁的熔点为172~173℃,在100℃开始升华.能溶于乙醚、二甲亚砜等溶剂,不溶于水,对碱和非氧化性酸稳定.某研究小组设计的实验方案和制备装置示意图如下: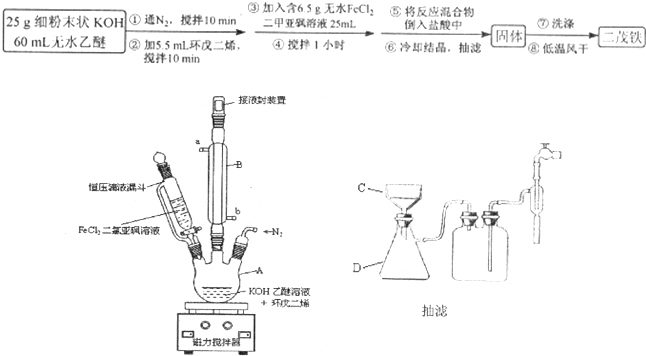
查看答案和解析>>
科目:高中化学 来源: 题型:
| 丁 |
| 丁 |
| 甲 |
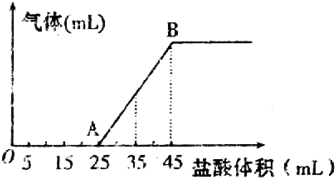
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al箔在空气中受热可以熔化,且发生剧烈燃烧 |
| B、Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性 |
| C、Al是地壳中含量最多的金属元素,但铝是使用较晚的金属 |
| D、Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al并不滴落 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60% | B、40% |
| C、24% | D、4% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、x=y+0.1 | ||
B、x=
| ||
C、x=0.05+
| ||
D、x=
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com