
常温下,对下列四种溶液的叙述正确的是
| | ① | ② | ③ | ④ |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
B
解析试题分析:①氨水是弱碱,当溶液稀释时,未电离的电解质分子会继续电离,使c(OH-)又略有增大,pH变化较小,③醋酸是弱酸当溶液稀释时,未电离的电解质分子会继续电离,使c(OH-)又略有增大,pH变化较小,而②氢氧化钠溶液和④的HCl都是强电解质,当加水稀释时,只有溶液的稀释作用,使离子的浓度减小,所以当稀释相同倍数时pH变化较大。因此稀释相同倍数时,pH变化最大的是②和④。错误。B.kw只与温度有关,②、④在相同的温度下,所以水溶液的两溶液kw相同。正确。C.向①加入少量的醋酸铵固体,对一水合氨的电离起抑制作用,所以溶液的pH均减小;向②加入少量的醋酸铵固体,铵根离子会与OH-离子结合形成一水合氨,使c(OH-)减小,所以溶液的pH均减小;向③中加入少量的醋酸铵固体后,由于增大了醋酸根离子的浓度,醋酸的电离平衡逆向移动,醋酸的电离程度减小,所以三种溶液的pH增大。错误。D.不符合电荷守恒的规律,应该是c(NH4+)>c(Cl-)> c(OH-) >c(H+)或者c(Cl-)>c(NH4+)>c(H+)>c(OH-)。错误。
考点:考查强、弱电解质电离的影响因素及溶液中离子浓度的大小比较的知识。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:单选题
下列说法或表达正确的是
| A.CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有: C(Na+)-c(CH3COO-)=c(OH-)-c(H+) |
| B.向ZnS白色悬浊液中加入CuSO4溶液,有黑色沉淀产生,是因为Ksp (ZnS)<Ksp (CuS) |
| C.向沸腾的NaOH溶液中滴加FeCl3饱和溶液,可以制备Fe(OH)3胶体 |
| D.热水中加入NaCl溶解至饱和后溶液的pH等于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是 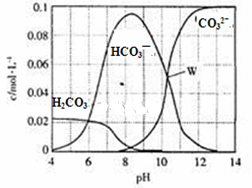
| A.W点所示的溶液中:c (Na+)+c (H+)=2c(CO32- )+c (OH-)+c (Cl-) |
| B.pH= 4的溶液中:c (H2CO3)+c (HCO3-)+c (CO32-)<0.1mol·L-1 |
| C.pH=8的溶液中:c (H+)+c (H2CO3)+c (HCO3-)= c (OH-)+c (Cl- ) |
| D.pH=11的溶液中:c (Na+)>c (Cl-)>c (CO32- )>c (HCO3- )>c (H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列说法正确的是( )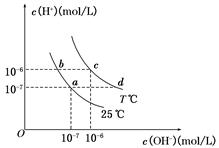
A.a点对应的溶液和c点对应的溶液pH值大小:
pH(c)>pH(a)
B.d点对应的溶液中大量存在:K+、Ba2+、NO3-、I-
C.25℃时,Ka(HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,
0.1mol/L的NaF溶液与0.1mol/L 的CH3COOK溶液相比:
c(Na+)-c(F-)>c(K+)-c(CH3COO-)
D.如b点对应的溶液中只含NaHA,则溶液中粒子浓度大小:
c(HA-)>c(H2A)>c(H+)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥pH=4、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
| A.①②④ | B.①③⑤ | C.③⑤⑥ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知在比较酸的强弱时,必须考虑两方面:一是电离出氢离子的能力,二是溶剂接受氢离子的能力。比如HCl在水中是强酸,在冰醋酸中就是弱酸;而HAc在水中是弱酸,在液氨中却是强酸,就是因为接受氢离子的能力:NH3>H2O>HAc。下列关于酸性强弱的说法正确的是( )
| A.在A溶剂中,甲的酸性大于乙;在B的溶剂中,甲的酸性可能小于乙 |
| B.比较HCl、H2SO4、HClO4、HNO3酸性的强弱,用水肯定不可以,用冰醋酸可能可以 |
| C.HNO3在HClO4中是酸,在H2SO4中可能是碱 |
| D.比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列溶液中的粒子浓度关系正确的是
| A.0.1 mol/L NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.1L0.1 mol/L Na2S溶液中:c(OH-)-c(H+)=c(HS-)+c(H2S) |
| C.室温下,pH=3.5的柑橘汁中c(H+)是pH=6.5的牛奶中c(H+)的1000倍 |
| D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中: |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向20.00 mL 0.1000 mol·L-1CH3COONa溶液中逐滴加入0.1000 mol·L-1盐酸,混合溶液的pH与所加盐酸体积的关系如图所示。下列说法正确的是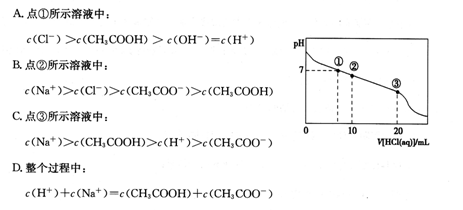
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向20.00 mL 0.100 mol·L-1 CH3COONa溶液中逐滴加入0.100 0 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如下图所示(不考虑挥发)。下列说法正确的是
| A.点①所示溶液中:c(CH3COOH)=c(Cl-)>c(OH-)=c(H+) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO-) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com