
| A. | ①② | B. | ③④ | C. | ①②③④ | D. | ①②③ |
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:Y小于X | |
| B. | 气态氢化物的稳定性:Y大于X | |
| C. | 最高价含氧酸的酸性:X强于Y | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
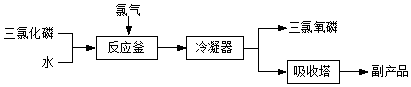
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)燃烧热△H=-283.0 kJ•mol-1,则反应2CO2(g)=2CO(g)+O2(g)的△H=2×283.0kJ•mol-1 | |
| B. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| C. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1,说明金刚石比石墨稳定 | |
| D. | 相同状况下,H2在Cl2中燃烧生成1molHCl和H2与Cl2光照爆炸生成1molHCl的反应热不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
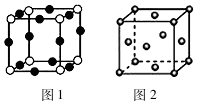 A、B、C、D、E是元素周期表中前36号元素,核电荷数依次增大,A与B能形成种类繁多的化合物,D原子中成对电子数等于未成对电子数的3倍;E+中所有电子正好充满K、L、M三个电子层.
A、B、C、D、E是元素周期表中前36号元素,核电荷数依次增大,A与B能形成种类繁多的化合物,D原子中成对电子数等于未成对电子数的3倍;E+中所有电子正好充满K、L、M三个电子层.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
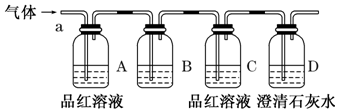
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1 molHC1和1 molKOH的两种稀溶液混合 | |
| B. | 含1 molHC1和0.5 molKOH 的两种稀溶液混合 | |
| C. | 含0.5mo溶质的浓硫酸和含1mol溶质KOH溶液混合 | |
| D. | 向0.5 mol溶质的浓硫酸和含2mol溶质的KOH溶液混合向1 molNa0H烧碱固体中加入足量1 mol•L-1的硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com