
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ②⑤ | C. | ⑤⑦ | D. | 除③④外 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层有两个电子的原子都是金属原子 | |
| B. | 最外层有五个电子的原子都是非金属原子 | |
| C. | 非金属元素呈现的最高化合价不超过该元素原子的最外层电子 | |
| D. | 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W三种元素组成化合物的水溶液不一定显碱性 | |
| B. | 在Z、Y形成的两种离子化合物中阴阳离子的个数比分别均为1:2 | |
| C. | 原子半径由大到小排列的顺序是:Z>R>W>Y>X | |
| D. | 由于X、Y组成化合物分之间可以形成氢键,使X、Y组成化合物的稳定性高于X、R组成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 实验②中发生反应的离子方程式为:Fe2++Cl2═Fe3++2Cl-;Fe3++3SCN-═Fe(SCN)3 | |
| B. | 通过上述实验可确定该化合物的化学式为:(NH4)2Fe(SO4)2•6H2O | |
| C. | 只做实验①③④,也能达到实验目的 | |
| D. | 为了检验SO42-,可以将③中的试剂换为HNO3酸化的Ba(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{16(b+a)}{b-a}$ | B. | $\frac{16(b-a)}{b+a}$ | C. | $\frac{8(b+a)}{b-a}$ | D. | $\frac{8(b-a)}{b+a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
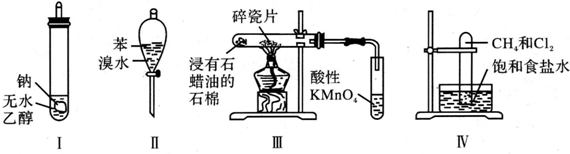
| A. | 实验Ⅰ:导管口气体可被点燃,产生淡蓝色火焰 | |
| B. | 实验Ⅱ:振荡后静置,溶液分层,且两层均接近无色 | |
| C. | 实验Ⅲ:试管中有气泡冒出,溶液颜色无明显变化 | |
| D. | 实验Ⅳ:试管内气体颜色逐渐变浅,试管壁出现油状液滴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com