
取6根铁钉,6支干净的试管及其他材料,如图所示。

试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触;
试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触;
试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片;
试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝。
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。
(1)上述实验中铁钉发生了电化学腐蚀的是____ (填试管序号);在电化学腐蚀中,负极反应是__________。
(2)从铁钉被腐蚀的情况可知引起和促 进铁钉被腐蚀的条件是___________。
进铁钉被腐蚀的条件是___________。
(3)为防止铁的锈蚀,工业上普遍采用的方法是_______(答两种方法)。
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源:2015-2016学年四川省高一上期末模拟化学试卷(解析版) 题型:选择题
“纳米材料”是粒子直径为1~100 nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是溶液 ②是胶体 ③能透过滤纸 ④不能透过滤纸
⑤能产生丁达尔效应 ⑥静置后,会析出黑色沉淀
A.①④⑥ B.②③④ C.②③⑤ D.①③④⑥
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上12月模拟化学试卷(解析版) 题型:填空题
一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。已知:2CO(g)+O2(g) 2CO2(g) △H1=-566.0kJ·mol-1;S(s)+O2(g)
2CO2(g) △H1=-566.0kJ·mol-1;S(s)+O2(g) SO2(g) △H2=-296.0kJ·mol-1;
SO2(g) △H2=-296.0kJ·mol-1;
请写出CO还原SO2的热化学方程式______________________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为 ,H2的平均生成速率为 mol·L-1·min-1。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图:
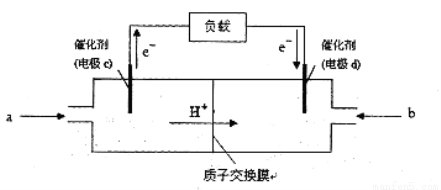
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为 。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的________极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上学期12月月考化学试卷(解析版) 题型:选择题
若NA代表阿伏伽德罗常数,则下列有关阿伏伽德罗常数的说法正确的是
A、1molNa与足量氧气充分反应转移电子数目为NA
B、1L0.1mol/LHCl溶液中含0.1NAHCl分子
C、100ml 1mol/L盐酸与0.1molNa2CO3无论如何滴加都产生0.05 NA 的CO2分子
D、0.1mol/L的AlCl3中Cl-的物质的量为0.3NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二上学期第一次质检化学试卷(解析版) 题型:实验题
I、某学生实验小组用50mL0.50mol•L—1的盐酸与50mL0.50mol•L—1的NaOH溶液在右图所示的装置中进行中和反应反应热的测定
(1)图中装置缺少的一种仪器,该仪器名称为 。

(2)将反应混合液的 温度记为反应的终止温度。
(3)下列说法正确的是
A.小烧杯内残留有水,会使测得的反应热数值偏小
B.可用相同浓度和体积的醋酸代替稀盐酸溶液进行实验
C.烧杯间填满碎纸条的作用是固定小烧杯
D.酸、碱混合时,应把量筒中的溶液缓缓倒入烧杯的溶液中,以防液体外溅
II、某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________。
(2)实验①和②的目的是____________________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是____________________。
(3)写出实验③的化学反应方程式 。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。

分析上图能够得出的实验结论是_______________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(普通班)化学试卷(解析版) 题型:选择题
下列对化学反应的认识正确的是
A.化学反应过程中,分子的种类和数目一定发生改变
B.如果某化学反应的△H和△S均小于0,则反应一定能自发进行
C.化学反应过程中,一定有化学键的断裂和形 成
成
D.所有的吸热反应一定要在加热的条件下才能进行
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(实验班)化学试卷(解析版) 题型:选择题
下列说法正确的是
A.增大反应物浓度可以增大活化分子百分数,从而使反应速率增大
B.汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能
C.在“反应热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度
D.研制性能优良的催化剂既可以提高化学反应速率,又能起到很好的节能效果
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高一上段考化学试卷(解析版) 题型:填空题
实验室可利用反应2KMnO4 + 16HCl=2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O制取氯气,请结合反应回答以下问题:
(1)用“单线桥法”表示反应中电子转移的方向和数目:
2KMnO4 + 16HCl=2KCl + 2MnCl2 + 5Cl2 + 8H2O
(2)该反应中,氧化剂是___________,氧化产物是_________,被氧化与未被氧化的HCl的物质的量之比为__________,若有7.3g HCl被氧化,则产生Cl2的质量为_____,转移的电子数为______。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上期末考试化学试卷(解析版) 题型:选择题
用括号内试剂除去下列各物质中的少量杂质,正确的是
A.溴苯中的溴(KI溶液) B.乙烷中的乙烯(酸性KMnO4溶液)
C.硝基苯中的NO2(NaOH溶液) D.苯中的己烯(Br2水)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com