
| A. | 150ml 1mol/L的NaCl溶液 | B. | 150ml 3mol/LKCl溶液 | ||
| C. | 75ml 2mol/L的NH4Cl溶液 | D. | 50ml 1mol/lCuCl2溶液 |
分析 电解质溶液中氯离子浓度=电解质浓度×电解质中氯离子数目,注意与溶液体积无关,以此解答该题.
解答 解:A.150 mL 1 mol•L-1NaCl溶液中氯离子浓度为1mol/L×1=1mol/L;
B.150 mL 3 mol•L-1KCl溶液中氯离子浓度为3mol/L×1=3mol/L;
C.75 mL 2 mol•L-1NH4Cl溶液中氯离子浓度为2mol/L×1=2mol/L;
D.50 mL 1 mol•L-1CuCl2溶液中氯离子浓度为1mol/L×2=2mol/L,
故150ml 1mol/L的NaCl溶液中氯离子浓度最小,
故选A.
点评 本题考查物质的量浓度有关计算,为高频考点,侧重于学生的分析能力的考查,比较基础,注意根据化学式理解电解质离子浓度与电解质浓度关系.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:解答题
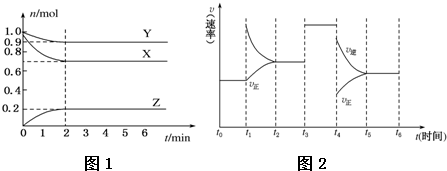
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
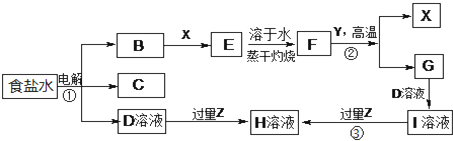
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Fe3+完全水解,生成氢氧化铁胶体的数目为NA | |
| B. | 22.4 LCl2 分别与足量的Cu、Fe完全反应转移电子数分别为2 NA、3NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5 NA | |
| D. | 1 mol/L Mg(NO3)2溶液中含有NO3-的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
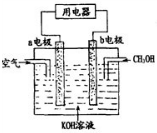 (1)2mol O3和 3mol O2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比1:1,体积之比为2:3.
(1)2mol O3和 3mol O2的质量之比为1:1,分子数之比为2:3,同温同压下的密度之比为3:2,含氧原子数之比1:1,体积之比为2:3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
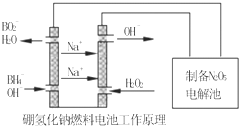 二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下
二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下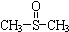 生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,有关反应如下:
生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,有关反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明溶液中:K+、Cu2+、SO42-、Na+ | |
| B. | pH=12的溶液中:K+、Na+、SO42-、CH3COO-、CO32- | |
| C. | 加入铝片能放出H2的溶液中:Na+、HCO3-、Cu2+、SO42- | |
| D. | 由水电离出的c(H+)=1×10-12 mol/L的溶液中:NH4+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | Ag | C. | Cl2 | D. | O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com