
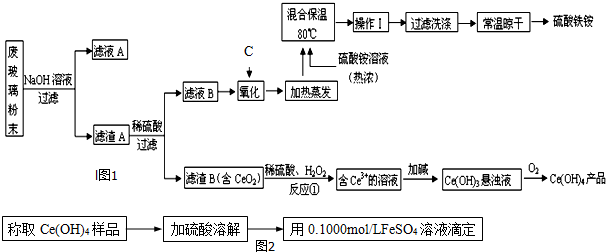
���� �ϲ�����ĩ������������Һ����ˣ��õ�����A�ijɷ���Fe2O3��CeO2��FeO������A��Fe2O3��CeO2��FeO����ϡ�������˵���ҺB������������Һ������������C������������������������Ӧ�������������ʣ�����B�ijɷ���CeO2��CeO2��H2O2��ϡH2SO4��Ӧ����Ce3+��O2��Ce3+�Ӽ�����Ce��OH��3����Һ��Ce��OH��3����Һ����������Ce��OH��4��
��1�����������ڣ�����������Ӧ�����������ʣ�
��2�����ݲ��������жϣ�����Һ���ɹ��壬Ӧ���Ƚ�������Ũ����Ȼ����ȴ�ᾧ��
��3��������������Fe3+��Fe2+��CeO2��H2O2��Ӧ����Ce2��SO4��3��O2��
��4���ζ�ʱ���ö�����������С�̶�Ϊ0.1ml��FeSO4��Һ�ڿ�����¶��һ��ʱ���ᱻ����������������������
��5��������Ԫ���غ���������������ʵ�������������������غ�������غ���������ѧʽ��
��� �⣺�ϲ�����ĩ������������Һ����ˣ��õ�����A�ijɷ���Fe2O3��CeO2��FeO������A��Fe2O3��CeO2��FeO����ϡ�������˵���ҺB������������Һ������������C������������������������Ӧ�������������ʣ�����B�ijɷ���CeO2��CeO2��H2O2��ϡH2SO4��Ӧ����Ce3+��O2��Ce3+�Ӽ�����Ce��OH��3����Һ��Ce��OH��3����Һ����������Ce��OH��4��
��1�����������ڣ�����������Ӧ�����������ʣ�ֻ��ѡ�ù������⣬�ʴ�Ϊ��B��
��2�����ݲ��������жϣ�����Һ���ɹ��壬Ӧ���Ƚ�������Ũ����Ȼ����ȴ�ᾧ���������������Һ�к���NH4+������Ϊȡ�����Թ��м���NaOH��Һ�����ȣ����Թܿ���һʪ��ĺ�ɫʯ����ֽ��
�ʴ�Ϊ����ȴ�ᾧ�� ȡ�����Թ��м���NaOH��Һ�����ȣ����Թܿ���һʪ��ĺ�ɫʯ����ֽ����ֽ����ɫ��֤������NH4+��
��3������A�ijɷ���Fe2O3��CeO2��FeO�������ᷴӦ����Һ�д���Fe3+��Fe2+��������������Fe3+��Fe2+��CeO2��H2O2��Ӧ����Ce2��SO4��3��O2����Ӧ�ķ���ʽΪ2CeO2+H2O2+3H2SO4=Ce2��SO4��3+O2��+4H2O��
�ʴ�Ϊ��Fe3+��Fe2+��2CeO2+H2O2+3H2SO4=Ce2��SO4��3+O2��+4H2O��
��4���ζ�ʱ���ö�����������С�̶�Ϊ0.1mL������0.01ml��FeSO4��Һ�ڿ�����¶��һ��ʱ���ᱻ���������������������ⶨ��Ce��OH��4��Ʒ������������ƫ��
�ʴ�Ϊ��0.1mL��ƫ��
��5����ȡ14.00g��Ʒ����������ˮ���ó�100mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�������������������صõ�1.60g����Ϊ��������n��Fe2O3��$\frac{1.6g}{160g/mol}$=0.01mol���������������������ʵ���Ϊ��n��Fe��OH��3��=0.02mol��
����һ����Һ�м���0.05mol Ba��NO3��2��Һ��ǡ����ȫ��Ӧ����n��SO42-��=0.05mol��
����14.00g��Ʒ�к���Fe2��SO4��30.02mol��n��SO42-��Ϊ0.1mol����NH4��2SO4Ϊ0.1mol-0.02mol��3=0.04mol��
��m��H2O��=14.00g-0.02mol��400g/mol-0.04mol��132g/mol=0.72g��
n��H2O��=$\frac{0.72g}{18g/mol}$=0.04mol��
n��Fe2��SO4��3����n����NH4��2SO4����n��H2O��=0.02��0.04��0.04=1��2��2��
���Ի�ѧʽΪFe2��SO4��3•2��NH4��2SO4•2H2O��
�ʴ�Ϊ��Fe2��SO4��3•2��NH4��2SO4•2H2O��
���� �����Թ�������Ϊ�����������˻�ѧʵ�����������Ԫ�ؼ�������֪ʶ��Ӧ�����֪ʶ���ᴿ�Ʊ���Ϊ�߿��������ͣ�������ѧ���ķ���������ʵ�������ͼ��������Ŀ��飬ע�����ʵ���ԭ���Ͳ�����������Ŀ�ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.5mol | B�� | 2mol | C�� | 2.5mol | D�� | 4mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ��ת�Ƶ���1.0mol | B�� | ����NO2����0.26mol | ||
| C�� | ԭHNO3Ũ��Ϊ8.0mol/L | D�� | ԭHNO3Ũ��Ϊ6.0mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
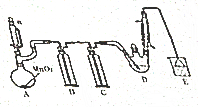 ij̽��С�������ͼ��ʾװ�ã��г֡����������ԣ���ģ�ҵ���������Ʊ�����ȩ��CCl3CHO����ʵ�飬�������ϣ��й���Ϣ��ͼ��ʾ��
ij̽��С�������ͼ��ʾװ�ã��г֡����������ԣ���ģ�ҵ���������Ʊ�����ȩ��CCl3CHO����ʵ�飬�������ϣ��й���Ϣ��ͼ��ʾ��| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| �۵�/�� | -114.1 | -57.5 | 58 | -138.7 |
| �е�/�� | 78.3 | 97.8 | 198 | 12.3 |
| �ܽ��� | ��ˮ���� | ������ˮ���Ҵ� | ������ˮ���Ҵ� | ����ˮ���������Ҵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������ˮ | B�� | ����ˮ�еIJ����� | ||
| C�� | ����ˮ��pH | D�� | ����ˮ�е�Cu2+���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ������Һ��ͱ��ڴ������������屽��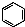 +Br2$\stackrel{FeBr_{3}}{��}$ +Br2$\stackrel{FeBr_{3}}{��}$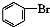 +HBr +HBr | |
| B�� | ��������ʳ�ף�CaCO3+CH3COOH=CH3COOCa+H2O+CO2�� | |
| C�� | ��CH2BrCOOH�м�������������������Һ�����ȣ�CH2BrCOOH+OH-$\stackrel{��}{��}$CH2BrCOO-+H2O | |
| D�� | ��������ˮ��Һ�м�������������Һ���ȣ�CH3CH2Cl+NaOH$\stackrel{��}{��}$CH2=CH2+NaCl+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ӽṹ�������� | B�� | �����в����ڹ¶Ե��� | ||
| C�� | ���ķе�����Ȼ��е�� | D�� | ���Ȼ���ˮ������������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com