
| V |
| Vm |
| n |
| V |
| V |
| Vm |
| m |
| ρ |
| 5 |
| 6 |
| 5 |
| 6 |
| 5 |
| 6 |
| VL |
| 22.4L/mol |
| V |
| 22.4 |
| ||
| VL |
| aL |
| 22.4L/mol |
| a |
| 22.4 |
| a |
| 22.4 |
| 17a |
| 22.4 |
(1000+
| ||
| 915g/L |
| 22400+17a |
| 22.4×915 |
| 22400+17a |
| 22.4×915 |
| a |
| 22.4 |


科目:高中化学 来源: 题型:
| A、1,3-二甲基戊烷 |
| B、2-甲基-3,3-二乙基丁烷 |
| C、3,4-二甲基戊烷 |
| D、2,3-二甲基-3-乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、皮肤上沾上浓硫酸应立即用氢氧化钠溶液中和 |
| B、酒精灯中酒精不慎洒出在桌上燃烧,应立即用湿布扑盖 |
| C、氢氧化钠溶液溅到眼睛中,立即闭上眼睛,轻轻揉搓 |
| D、实验中出现轻微气体中毒,受伤人员应立即伏到实验桌上好好休息 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
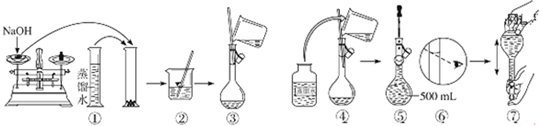
查看答案和解析>>
科目:高中化学 来源: 题型:
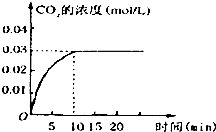 在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应.测得CO2的浓度随时间变化的图象如图:
在容积为1L的密闭容器内,加入0.1molCO和0.1molH2O,在催化剂存在的条件下高温加热使其反应.测得CO2的浓度随时间变化的图象如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com