
分析 (1)次氯酸钙是漂白粉或漂粉精的有效成分;
(2)常温下能使铝铁钝化的是浓硫酸或是浓硝酸;
(3)能使石蕊试液先变红后褪色的物质具有酸性且具有氧化性;
(4)能做木材防火剂的是耐火材料;
(5)能做净水剂的是可以产生氢氧化铁或是氢氧化铝胶体的物质;
(6)过氧化钠可以和水、二氧化碳都可以反应产生氧气;
(7)能做处理胃酸过多的一种药剂必须是可以和盐酸反应的物质;
(8)二氧化硅晶体对光具有全反应作用,能传到光信号.
解答 解:(1)漂白粉或漂粉精是氯气与氢氧化钙反应生成的,次氯酸钙是漂白粉或漂粉精的有效成分,
故答案为:H;
(2)常温下能使铝铁钝化的是浓硫酸或是浓硝酸,故答案为:C;
(3)能使石蕊试液先变红后褪色的物质具有酸性且具有氧化性,应该是新制氯水,其中含有盐酸和次氯酸,故答案为:E;
(4)硅酸钠不燃烧,也不支持燃烧,硅酸钠的水溶液能做木材防火剂,是耐火材料,故答案为:A;
(5)能做净水剂的是可以产生氢氧化铁或是氢氧化铝胶体的物质,如明矾,故答案为:B;
(6)过氧化钠可以和水、二氧化碳都可以反应产生氧气,常做供氧剂,故答案为:D;
(7)能做处理胃酸过多的一种药剂必须是可以和盐酸反应的物质,可以选择碳酸氢钠,故答案为:F;
(8)二氧化硅晶体对光具有全反应作用,能传到光信号,所以能做光纤制品的是二氧化硅,故答案为:G.
点评 本题考查了元素化合物的性质和用途,题目难度不大,侧重于基础知识的应用,注意把握常见元素化合物的性质和用途,有利于培养学生对基础知识的综合应用能力.


科目:高中化学 来源: 题型:实验题
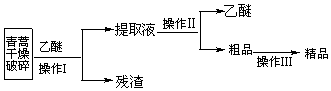
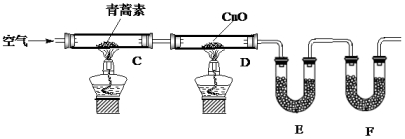
| 装置 | 实验前 | 实验后 |
| E | 24.00g | 33.90g |
| F | 100.00g | 133.00g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3 溶液中:c(H+)+c(H2CO3)═c(CO32-)+c(OH-) | |
| B. | 0.1 mol/L醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后的溶液中:c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 物质的量浓度相等的①NH4Cl、②(NH4)2SO4、③NH4Al(SO4)2三种溶液中,c(NH4+) 由大到小的顺序为③>②>① | |
| D. | 浓度均为0.1 mol/L的①氨水、②NaOH溶液、③Na2CO3溶液、④NaHCO3溶液,pH的大小顺序;②>③>④>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O | |
| C. | 充电时,蓄电池的负极应与外接电源正极相连 | |
| D. | 放电时负极附近溶液的碱性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3既不是氧化剂也不是还原剂 | B. | Cl2被还原 | ||
| C. | 每生成1 mol CO2转移2 mol电子 | D. | CO2为氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
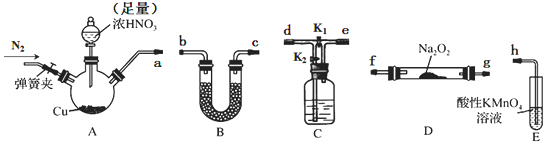
| 步骤 | 操作及现象 |
| ① | 关闭K2,打开K1,打开弹簧夹通一段时间的氮气,夹紧弹簧夹,开始A中反应,一段时间后,观察到E中溶液逐渐变为深棕色. |
| ② | 停止A中反应,打开弹簧夹和K2、关闭K1,持续通入N2一段时间. |
| ③ | 更换新的E装置,再通一段时间N2后关闭弹簧夹,使A中反应继续,观察到的现象与步骤①中相同. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com