
| A. | ①表示2molC(s)燃烧生成2molCO(g)需要吸收221 kJ的热量 | |
| B. | 碳的燃烧热大于110.5 kJ/mol | |
| C. | 稀硫酸与浓NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
分析 A.该反应的焓变为负值,为放热反应;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物反应放出的热量;
C.中和热是强酸强碱的稀溶液反应生成1mol水放出的热量;
D.醋酸是弱酸存在电离平衡,电离过程是吸热反应.
解答 解:A.反应热化学方程式分析可知是放热反应,焓变为负值,①表示2mol C(s)燃烧生成2mol CO(g)需要放出221kJ的热量,故A错误;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物反应放出的热量,碳的燃烧热大于 110.5kJ/mol,故B正确;
C.中和热是强酸强碱的稀溶液反应生成1mol水放出的热量,稀硫酸与浓NaOH溶液反应,浓氢氧化钠溶液溶解放热,反应放出的热量大于中和热,反应的中和热为△H<-57.3kJ/mol,故C错误;
D.醋酸是弱酸存在电离平衡,电离过程是吸热反应,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3kJ,故D错误;
故选B.
点评 本题考查反应热与焓变,题目难度不大,涉及燃烧热、中和热概念的分析判断,注意弱电解质电离平衡过程是吸热过程,试题培养了学生的分析能力及灵活应用基础知识的能力.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 745 | 465 | 413 |
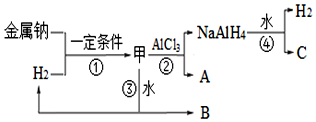
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,2-二甲苯也称邻二甲苯 | |
| B. | 氨基乙酸与a-氨基丙酸的混合物一定条件下脱水能生成4种二肽 | |
| C. | 苯与溴水不能发生加成反应,所以两者混合后无明显现象 | |
| D. | C5H10O2属于羧酸的同分异构体有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
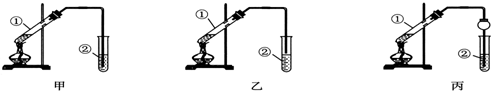
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L Cl2中含有的分子数为6.02×1023个 | |
| B. | 0.1mol/LNa2CO3溶液加热后,溶液的pH减小 | |
| C. | 氢氧燃料电池工作时,H2在负极上失去电子 | |
| D. | 室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -332 | B. | -118 | C. | 350 | D. | 130 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数35 | B. | 中子数19 | C. | 核电荷数35 | D. | 质子数16 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com