
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
分析 A、B、C、D、E为原子序数依次增大的五种短周期元素,B、C和E在周期表中相邻,且C、E同主族,所以B、C、E在周期表中的位置关系为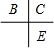 ,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含有一种金属元素,由元素周期律可知该元素只能为D,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,又由于A和C可形成两种常见的液态化合物,则A为H元素、C为O元素、B为N元素、E为S元素、D为Na,A和C可形成化合物H2O、H2O2,据此解答.
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含有一种金属元素,由元素周期律可知该元素只能为D,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,又由于A和C可形成两种常见的液态化合物,则A为H元素、C为O元素、B为N元素、E为S元素、D为Na,A和C可形成化合物H2O、H2O2,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的五种短周期元素,B、C和E在周期表中相邻,且C、E同主族,所以B、C、E在周期表中的位置关系为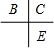 ,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含有一种金属元素,由元素周期律可知该元素只能为D,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,又由于A和C可形成两种常见的液态化合物,则A为H元素、C为O元素、B为N元素、E为S元素、D为Na,A和C可形成化合物H2O、H2O2.
,A和D最外层电子数相同,则二者处于同族,原子序数D大于C小于E,则D为第三周期,其中仅含有一种金属元素,由元素周期律可知该元素只能为D,B、C的最外层电子数之和等于D的原子核外电子数,D的核外电子数为奇数,则D为钠元素或铝元素,又由于A和C可形成两种常见的液态化合物,则A为H元素、C为O元素、B为N元素、E为S元素、D为Na,A和C可形成化合物H2O、H2O2.
(1)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->O2->Na+,故答案为:S2->O2->Na+;
(2)①H、N、O、Na中的任意三种元素可组成多种化合物,X和Y是其中的两种.X 和Y都是既含离子键又含共价键的离子化合物,则X和Y为盐或碱,将X、Y分别溶于水时,X能促进水的电离,X水溶液的pH<7,则X为铵盐,故X为NH4NO3,而Y能抑制水的电离,Y水溶液的pH>7,则Y为碱,故Y为NaOH,
故答案为:NH4NO3;NaOH;
②将0.2mol•L-1的NH4NO3溶液与0.1mol•L-1的NaOH溶液等体积混合,则混合后发生反应,相当于NH4NO3、NH3•H2O、NaNO3等物质的量混合,溶液呈碱性,进行说明NH4+水解小于NH3•H2O电离程度,则c(NH4+)>c(Na+ ),故混合溶液中各种带电微粒的物质的量浓度由大到小的顺序为:c(NO3-)>c(NH4+)>c(Na+ )>c(OH-)>c(H+),
故答案为:c(NO3-)>c(NH4+)>c(Na+ )>c(OH-)>c(H+);
(3)氢气、氧气与熔融K2CO3,组成的燃料电池,氢气在负极放电,在熔融碳酸钾条件下生成二氧化碳与水,负极电极反应式为:H2+CO32--2e-=CO2↑+H2O;
用该电池电解1L1mol/LNaCl溶液,当消耗标准状况下1.12LH2时,氢气的物质的量=$\frac{1.12L}{22.4L/mol}$=0.05mol,生成的NaOH物质的量=0.05mol×2=0.1mol,故n(OH-)=0.1mol/L,则c(H+)=$\frac{1{0}^{-14}}{0.1}$=10-13,故l溶液的pH=-lg10-13=13,
故答案为:H2+CO32--2e-=CO2↑+H2O;13;
(4)亚硫酸的一级电离平衡常数大于碳酸的,则亚硫酸的酸性更强,亚硫酸的二级电离平衡常数小于碳酸的一级电离平衡常数,说明亚硫酸根的酸性比碳酸的酸性弱,故H2SO3溶液和NaHCO3溶液反应的主要离子方程式为:H2SO3+HCO3-=HSO3-+H2O+CO2↑,
故答案为:H2SO3+HCO3-=HSO3-+H2O+CO2↑;
(5)反应生成二氧化碳,碳元素被氧化,紫红色褪去,则MnO4-还原为Mn2+,反应离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,该反应开始时速率较慢,随后大大加快,可能的原因是:反应生成Mn2+对反应起到催化作用,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;反应生成Mn2+对反应起到催化作用.
点评 本题以元素推断为载体,考查结构性质位置关系、微粒半径比较、盐类水解、原电池、电离平衡常数、氧化还原反应、化学反应速率影响因素等,是对知识综合运用与学生能力考查,推断元素是关键,需充分利用信息,对知识全面掌握,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
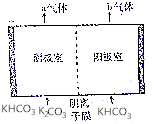 为实现CO2减排,目前较成熟的方法是用碳酸钾溶液为吸收剂捕集工业烟气中的CO2.利用电解法可实现吸收后的溶液(称为富液)的再生.将富液通人阴极室,将KHCO3溶液加入阳极室进行电解,其原理如图所示.下列有关描述不正确的是( )
为实现CO2减排,目前较成熟的方法是用碳酸钾溶液为吸收剂捕集工业烟气中的CO2.利用电解法可实现吸收后的溶液(称为富液)的再生.将富液通人阴极室,将KHCO3溶液加入阳极室进行电解,其原理如图所示.下列有关描述不正确的是( )| A. | 阴极室产生的a气体是H2 | B. | 阳极室产生的b气体是CO2 | ||
| C. | 阴离子从阴极室向阳极室迁移 | D. | 再生液(K2CO3)在阴极室产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法判断固体中FeCl2是否存在 | |
| B. | ③中使高锰酸钾溶液褪色的是亚硝酸根离子 | |
| C. | B的pH<7 | |
| D. | 固体由Ba(OH)2、AlCl3、Na2SO3组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能加快化学反应速率 | |
| B. | 增大O2浓度可以使SO2转化率达到100% | |
| C. | 降低反应温度,化学反应速率减慢 | |
| D. | 增大O2浓度,化学反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯分子中含碳碳双键 | |
| B. | 以淀粉为原料可制取乙酸乙酯 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 油脂的皂化反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
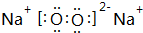 ,7.8g该化合物与足量的CO2反应,转移电子数目为6.02×1022,固体增重为2.8g.
,7.8g该化合物与足量的CO2反应,转移电子数目为6.02×1022,固体增重为2.8g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
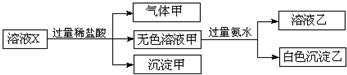 水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图实验:下列判断正确的是( )
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如图实验:下列判断正确的是( )| A. | 沉淀甲不一定是纯净物 | |
| B. | 溶液中一定有Al3+和CO32-和SiO32- | |
| C. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| D. | CO32-和SO42-一定不存在于溶液X中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com