2.3g某有机物A完全燃烧后,生成0.1molCO2和2.7gH2O,测得该化合物的蒸气对氢气的相对密度是23.求该有机物的分子式.并写出该有机物可能的结构式.
【答案】
分析:根据该化合物的蒸气对氢气的相对密度可求得2.3g有机物的物质的量,根据CO
2和H
2O的质量判断2.3g有机物中是否含有O元素,并计算O原子的质量,进而计算C、H、O的物质的量比值,结合相对分子质量可得该有机物的化学式.
解答:解:n(CO
2)=0.1mol,
则2.3g有机物中:n(C)=n(CO
2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,
n(H
2O)=
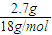
=0.15mol,
则2.3g有机物中:n(H)=2n(H
2O)=0.3mol,m(H)=0.3mol×1g/mol=0.3g,
因(1.2g+0.3g)<2.3g,
所以有机物中还应还用O元素,且m(O)=2.3g-1.2g-0.3g=0.8g,n(O)=
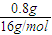
=0.05mol,
则有机物中:n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,
所以该有机物的最简式为C
2H
6O,
又该化合物的蒸气对氢气的相对密度是23,则M=2×23=46,
而C
2H
6O的相对分子质量为46,
所以,该有机物的分子式为C
2H
6O,为乙醇或二甲醚,结构简式为:CH
3CH
2OH或CH
3-O-CH
3.
答:该有机物的分子式为C
2H
6O,可能的结构简式为CH
3CH
2OH或CH
3-O-CH
3.
点评:本题考查有机物分子式的确定,题目难度不大,注意根据生成物的质量和有机物的质量判断有机物中是否含有O元素为解答该题的关键.

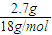 =0.15mol,
=0.15mol,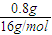 =0.05mol,
=0.05mol,

 一线名师权威作业本系列答案
一线名师权威作业本系列答案