
 (2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.分析 (1)①2N2(g)+6H2O(1)=4NH3(g)+3O2(g)△H=+1530kJ•mol-1
②又知:H2O(g)═H2O(1)△H=-44.0kJ•mol-1,
反应-(①+②)可以得到:4NH3(g)+3O2(g)=2N2(g)+6H2O(g),根据盖斯定律计算反应的△H;根据影响化学反应速率和平衡移动的因素来回答;
(2)①如果保持其他条件不变的情况下使用催化剂,则不会改变化学平衡移动,但是会加快反应速率,根据三行式计算平衡时氨气的浓度;
②若保持其他条件不变,向平衡体系中再通入2molNH3和2molH2O,根据Qc和K的关系判断反应进行的方向.
解答 解:(1)①2N2(g)+6H2O(1)=4NH3(g)+3O2(g)△H=+1530kJ•mol-1
②又知:H2O(g)═H2O(1)△H=-44.0kJ•mol-1,
反应-(①+②)可以得到:4NH3(g)+3O2(g)=2N2(g)+6H2O(g),根据盖斯定律,得到反应的△H=-(1530kJ•mol-1+44.0kJ•mol-1)=-1266kJ•mol-1;
A.向平衡混合物中充入Ar,在恒容密闭容器中,各组分浓度不变,所以速率不变,平衡不动,故A错误;
B.向平衡混合物中充入O2,正逆反应速率加快,平衡正向移动,故B正确;
C.采用更好的催化剂不会改变化学平衡移动,只是会加快反应速率,故C错误;
D.降低反应的温度会降低反应速率,故D错误,故答案为:-1266;B;
(2)①1L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%.
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)
初始浓度:4 2 0 0
变化浓度:2 1 1 1
平衡浓度:2 1 1 1
加入催化剂,不会改变化学平衡移动,但是会加快反应速率,得到c(NH3)随时间的变化曲线如下图所示: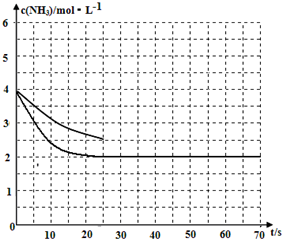 ,故答案为:
,故答案为: ;
;
②若保持其他条件不变,向平衡体系中再通入2molNH3和2molH2O,此时Qc=$\frac{3×1}{{4}^{2}×1}$<K=0.25,所以平衡会正向移动,v正>v逆.故答案为:>.
点评 本题考查了热化学方程式和盖斯定律的计算、图象分析,化学平衡计算,平衡常数概念的分析应用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 序号 | A | B | C |
| 装置 | 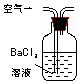 | 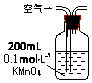 | 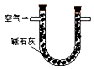 |
| 原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2)/mol | 0 | 1 | 3 | 1 |
| n(H2)/mol | 0 | 2 | 2 | 1 |
| n(CO)/mol | 3 | 0.5 | 1 | 2 |
| n(H2O)/mol | 3 | 2 | 5 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度(mol•L-1) | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| H-H | 436 | C-F | 427 | H-S | 339 |
| S=S | 255 | C-C1 | 330 | H-F | 565 |
| C1-C1 | 243 | C-I | 218 | H-C1 | 431 |
| O=O | ? | H-O | 464 | H-Br | 366 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,反应2NH3(g)?N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示.下列说法正确的是( )
一定条件下,反应2NH3(g)?N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示.下列说法正确的是( )| A. | 压强:p1>p2 | B. | b、c两点对应的平衡常数:Kc>Kb | ||
| C. | a点:2v(NH3)正═3v(H2)逆 | D. | a点:NH3的转化率为$\frac{1}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
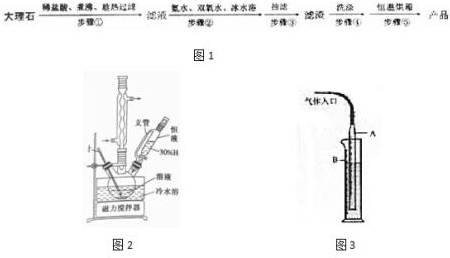
| 测定次数 | 收集前读数/mL | 收集后读数/mL |
| 第1次 | 21.06 | 4.24 |
| 第2次 | 23.52 | 6.72 |
| 第3次 | 22.41 | 5.63 |
| 第4次 | 20.80 | 7.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com