
下图的各方框表示有关的一种反应物或生成物(某些物质已略去),其中常温
下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝,X中阴阳离子个数相等。
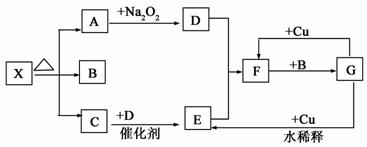
(1)写出下列各物质的化学式:
X: ;B: ;F: 。
(2)写出下列变化的化学方程式:
A→D: ;
C→E: 。
(3)实验室里,除了用加热固体混合物的方法制取气体C以外,还可以采用
方法(填写具体物质和方法)来制取气体C,干燥气体C常用药品为 。
(4)写出物质X的一种重要用途 ,X的储存方法 。
科目:高中化学 来源: 题型:
药物阿司匹林的结构简式为 。1 mol阿司匹林与足量NaOH溶液反应,消耗NaOH的物质的量为( )
。1 mol阿司匹林与足量NaOH溶液反应,消耗NaOH的物质的量为( )
A.1 mol B.2 mol
C.3 mol D.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在相同状况下,同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。下列说法正确的是( )
A.电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应
B.水分解产生氢气和氧气时放出能量
C.相同状况下,反应2SO2+O2===2SO3是一个放热反应,则反应2SO3===2SO2+O2是一个吸热反应
D.氯化氢分解成氢气和氯气时放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式的书写正确的是( )
A.铁和稀硫酸反应:2Fe + 6H+ = 2Fe 3+ + 3H2↑
B.NaHCO3溶液与NaOH溶液反应:OHˉ + HCO3ˉ = CO32ˉ + H2O
C.钠和冷水反应:Na + 2H2O = Na+ + 2OHˉ + H2↑
D.氯气通入水中:Cl2 + H2O = 2H+ + Clˉ + ClOˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,在一盛有蒸馏水的烧杯中有一悬浮的小球,当向烧杯中
加入(或通入)下列物质后,小球沉到水底的是( )
A.HCl B.NH3
C.浓H2SO4 D.浓HNO3

查看答案和解析>>
科目:高中化学 来源: 题型:
分类思想是学习化学的重要思想,从分类的角度分析正确的是( )
A.SO2和NO2溶于水都显酸性,因而它们都是酸性氧化物
B.Na2O和NH3的水溶液均能导电,故均为电解质
C.Si和SiO2均属于原子晶体
D.Na2O和Na2O2与水反应均会生成强碱,故都是碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.向澄清石灰水中加入等物质的量的NaHCO3溶液:
Ca2++2OH-+ 2HCO3- = CaCO3↓+CO32-+2H2O
B.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:
Ba2+ + 2OH- + NH4+ + H+ + SO4 2- = BaSO4↓+ NH3·H2O + H2O
C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
D.明矾溶液中加入氢氧化钡溶液,使其产生沉淀的物质的量达最大值:
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯
化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪个氧化性更强?
(2)猜想:①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含 (填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述现象是发生氧化还原反应所致,则溶液呈黄色是含 所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的。供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到得现象。
| 选用试剂(填序号) | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)结论
氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为 。
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是 。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电化学原理的说法错误的是( )
A.氯化铝的熔点比氧化铝低,因此工业上最好采用电解熔融氯化铝来制备单质铝
B.电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极
C.对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法
D.对大型船舶的外壳进行的“牺牲阳极的阴极保护法”,是应用了原电池原理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com