
【题目】下列热化学方程式正确的是( )
选项 | 已知条件 | 热化学方程式 |
A | H2的燃烧热为a kJ·mol-1 | H2+Cl2 |
B | 1 mol SO2、0.5 mol O2完全反应,放出热量98.3 kJ | 2SO2(g)+O2(g) ΔH=-98.3 kJ·mol-1 |
C | H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 | H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1 |
D | 31 g白磷比31 g红磷能量多b kJ | P4(白磷,s)=4P(红磷,s)ΔH=-4b kJ·mol-1 |
A.AB.BC.CD.D
 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
nCH3CH=CH2![]()
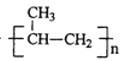
TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
(1)Ti3+的基态核外电子排布式为__________。
(2)丙烯分子中,碳原子轨道杂化类型为______和____。
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________。
(4)写出一种由第2周期元素组成的且与CO互为等电子体的阴离子的电子式________。
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,结构式分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______。

(6)钛酸锶具有超导性、热敏性及光敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置,据此推测,钛酸锶的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置进行脱硫,将硫化氢气体转化成硫沉淀。已知甲、乙池中发生的反应为(右图):下列说法正确的是
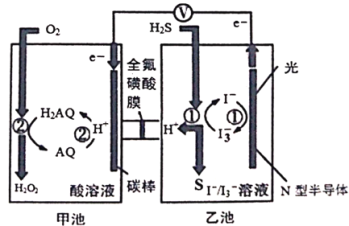
A. 甲池中得到H2O2的反应,H2O2既是氧化产物也是还原产物
B. 电路中每转移0.2mol电子,甲池溶液质量变化3.4g,乙池溶液质量保持不变
C. 光照时乙池电极上发生的反应为:H2S+I3-=3I-+S+2H+
D. 甲池中炭棒上发生的电极反应为:AQ+2H+-2e-=H2AQ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的衍生物A的化学式为C6H12O2,已知:

又知D不与Na2CO3反应,C和E均不能发生银镜反应,则A的结构可能有( )
A.2种B.3种C.4种D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结论与实验操作及现象不相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某酸雨样品中加入Ba(OH)2溶液,有白色沉淀生成 | 酸雨试样中一定含SO42- |
B | 向KI-淀粉溶液中滴入氯水,溶液变成蓝色 | I-的还原性强于Cl- |
C | 将Ba(OH)2·8H2O和NH4Cl晶体在小烧杯中混合搅拌,用手触摸烧杯外壁感觉变凉 | Ba(OH)2·8H2O与NH4Cl的反应是吸热反应 |
D | 向某盐溶液中加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口,试纸变蓝 | 该盐溶液中含有NH4+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol金属钠和l mol氯气反应的能量关系如图所示,下列说法不正确的是:( )
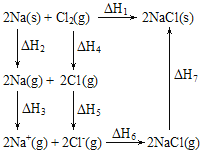
A.原子失电子为吸热过程,相同条件下,K(s)的(△H2'+△H3')<Na(s)的(△H2+△H3)
B.△H4的值数值上和Cl-Cl共价键的键能相等
C.△H2+△H3+△H4+△H5>-(△H6+△H7)
D.2Na(s)+Cl2(g)=2NaCl(s)在较低温度下自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁与稀硝酸的反应为:Mg+HNO3(稀)——Mg(NO3)2+NO↑+H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目_____________。
(2)该反应中,还原产物是_________,HNO3表现了___________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。还原剂与氧化剂的的物质的量之比为____________。
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向恒容的密闭容器中充入一定量的NO2(g),发生反应2NO2(g)![]() N2O4(g)△H<0。下列选项中不能作为判断反应是否达到平衡状态的因素的是
N2O4(g)△H<0。下列选项中不能作为判断反应是否达到平衡状态的因素的是
A.混合气体的平均相对分子质量B.NO2(g)的百分含量
C.容器内压强D.NO2和N2O4的反应速率之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如下图所示。下列说法中正确的是( )
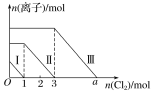
A.线段Ⅲ代表Fe2+的变化情况
B.线段Ⅰ代表Br-的变化情况
C.a值等于6
D.原混合溶液中n(FeBr2)=4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com