
【题目】现有下列仪器或装置,请回答下列问题:
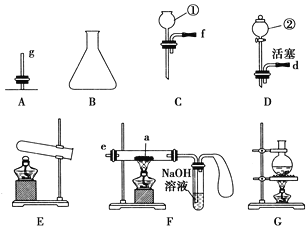
(1)仪器①的名称是________,②的名称是________。
(2)用上图仪器组装成气体发生装置:用KClO3和MnO2制O2应选的装置是________(填字母);用废H2O2与MnO2制O2,并控制产生O2的速率,应选________(填字母)。
(3)若用装置X进行“排空气法”收集制取的O2,氧气应从________(填“b”或“c”)端导入。若瓶中装满水,用排水法收集氧气,氧气应从________(填“b”或“c”)端导入。
(4)若用F装置进行CO还原Fe2O3的实验,实验室制取CO的方法一般采取甲酸脱水法(HCOOH![]() CO↑+H2O),用纯净的CO完成该实验。
CO↑+H2O),用纯净的CO完成该实验。
①除F、X外还需要的装置有________,X中应加入的试剂是________,X与其它导管连接的顺序是________(填导管口的序号);
②实验时,a处的可能的现象为_________________;F装置中气球的作用是_______________。
【答案】长颈漏斗分液漏斗AEBDcbDG浓硫酸dcbe红棕色粉末逐渐变黑收集尾气中的一氧化碳,防止污染
【解析】
(1)根据仪器的构造可知①为长颈漏斗、②为分液漏斗。
(2)用KClO3和MnO2制O2的反应物是固体且需要加热,还需要用导气管将气体导出,故选用AE;用H2O2与MnO2制O2,并控制产生O2的速率,反应物是固体和液体,不需要加热,反应容器用锥形瓶即可,由于分液漏斗有开关,可以通过开关调节液体的流速,从而控制反应速度,故选用BD。
(3)氧气密度比空气大,应该用向上排空气法收集,气体从c进入,空气便于从b排出,相当于向上排空气法;装满水正放,排水法收集气体时,由于气体的密度都比水的密度小,所以要从b进入,才能把水排出去。
(4)①根据反应原理可知,制取CO属于液-液加热制取气体的反应,用分液漏斗控制加入浓硫酸的量,应选用DG为气体发生装置,X作用是除去CO中的水蒸气,故X中应加入的试剂是浓硫酸,X与其他导管连接的顺序是dcbe。
②用F装置进行CO还原Fe2O3的实验,e处进入纯净的CO,在a处与Fe2O3反应生成铁单质,故a处可能的现象为红棕色粉末逐渐变黑;CO有毒,则F装置中气球的作用是收集尾气中的一氧化碳,防止污染空气。


科目:高中化学 来源: 题型:
【题目】下列化学用语或有关物质性质的描述正确的是
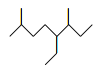
A. 如上图所示的键线式表示的烃的名称为:3-甲基-4-乙基-7-甲基辛烷
B. 符合分子式C3H8O的醇有3种不同的结构
C. 乙烯在一定条件下能发生加成反应、加聚反应,还能被酸性高锰酸钾溶液氧化
D. 治疗疟疾的青蒿素的结构简式为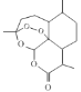 ,分子式是Cl5H20O5
,分子式是Cl5H20O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. Na投入到CuSO4溶液中:2Na+Cu2+=2Na++Cu
B. 用石墨电极电解CuCl2溶液:2Cu2++2H2O![]() 2Cu↓+4H++O2↑
2Cu↓+4H++O2↑
C. 向Na2S2O3溶液中滴加等物质的量的稀硫酸:S2O32-+2H+=S↓+SO42-+H2O
D. 向Mg(OH)2沉淀中滴加过量氯化铵溶液:Mg(OH)2+2NH4+=Mg2++2NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,用离子方程式解释其目的__________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,请你代表乙组发表改进方案_____________。
(二)工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下:
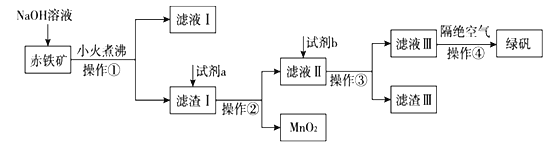
(4)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为____________________________。
(5)向滤渣Ⅰ中加入过量的试剂a为___________,加入过量试剂b后所得滤渣Ⅲ的主要成分为______。
(6)操作③需要的玻璃仪器主要包括_______________。
(7)操作④需要隔绝空气的主要原因可能是什么?______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置是化学实验中的常用装置,它有多种用途,以下各项用途和操作都正确的是
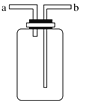
A. 洗气或干燥装置:瓶内放一定体积溶液,由a管口进气
B. 用于收集不溶于水的气体:瓶内充满水,由b管口进气
C. H2S和SO2反应的装置:由a管口通入H2S,b管口通入SO2
D. 提供少量CO:瓶内充满CO,b管口接自来水龙头
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅、铜、镓、硒等化学物质可作为制造太阳能电池板的材料。
(1)镓是ⅢA族元素,写出基态镓原子的核外电子排布式__________________。
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由大到小的顺序为______________(用元素符号表示)。
(3)SeO3分子的立体构型为____,与硒同主族元素的氢化物(化学式为H2R)中,沸点最低的物质化学式为____。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的关系如图所示,呈现这种变化的原因是____________。

(5)金属铜投入氨水中或投入过氧化氢溶液中均无明显现象,但投入氨水与过氧化氢的混合液中,则铜片溶解,溶液呈深蓝色,写出使溶液呈深蓝色的离子的化学式_____。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数之比为____________,若该晶体的晶胞边长为a pm,则该合金的密度为________________g·cm-3(列出计算式,不要求计算结果,设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
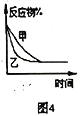
【题目】下列图示与对应的叙述相符的是( )
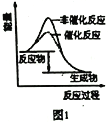


A. 图1表示分别在有、无催化剂的情况下某吸热反应过程中的能量变化
B. 图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线)
C. 图3表示mg冰醋酸加水稀释过程中溶液导电能力的变化,其中醋酸的电离度c>b>a
D. 图4表压强对合成氨反应的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图装置进行实验,甲乙两池均为1 mol·L–1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,灵敏电流计指针发生偏转(提示:Ag+ 浓度越大,氧化性越强),下列说法不正确的是
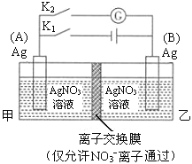
A.闭合K1,断开K2后,A电极增重
B.闭合K1,断开K2后,乙池溶液中Ag+浓度增大
C.断开K1,闭合K2后,B电极发生氧化反应
D.断开K1,闭合K2后,NO3–向A电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向80mL浓硫酸中加入56g铜片,加热一段时间后,至不再反应为止,计算:
(1)实验测得反应中共有13.44L标准状况下的SO2生成,被还原的硫酸的物质的量为_____mol,反应中转移的电子有_____mol。
(2)将反应后的混合物加水稀释到100mL并除去不溶物,加入足量锌粉放出标准状况下5.376L氢气,则原浓硫酸的物质的量浓度为_____,反应的Zn的质量为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com