
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是
(2)KMnO4 - 氧化Fe2+的离子方程式补充完整:
(3)已知:生成氢氧化物沉淀的pH
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)Al2O3+6H+=2Al3++3H2O(2分);(2)5、8H+、5、4H2O(4分);
(3)pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀(2分);
(4)①生成有黄绿色气体(2分); ②除去过量的MnO4-(2分)。
解析试题分析:(1)氧化铝与硫酸反应生成硫酸铝与水;
(2)反应中MnO4-→Mn2+,Fe2+→Fe3+, MnO4-系数为1,根据电子转移守恒可知,Fe2+系数为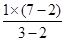 =5,由元素守恒可知, Fe3+系数为5,由电荷守恒可知,由H+参加反应,其系数为8,根据元素原子守恒可知,有H2O生成,其系数为4,方程式配平为MnO4-+5 Fe2++8H+=Mn2++5Fe3++4H2O;
=5,由元素守恒可知, Fe3+系数为5,由电荷守恒可知,由H+参加反应,其系数为8,根据元素原子守恒可知,有H2O生成,其系数为4,方程式配平为MnO4-+5 Fe2++8H+=Mn2++5Fe3++4H2O;
(3)滤液中含有Fe2+,由表中数据可知,Fe(OH)2开始沉淀的pH大于Al(OH)3 完全沉淀的pH值,而Fe(OH)3完全沉淀的pH值小于Al(OH)3开始沉淀的pH值,pH值约为3时,Al3+、Fe2+不能沉淀,步骤Ⅱ是将Fe2+氧化为Fe3+,调节pH值使铁完全沉淀;
(4)①MnO2能将HCl氧化为Cl2,若有黄绿色气体生成说明沉淀中存在MnO2;
②Ⅲ 的上层液呈紫红色,MnO4-过量,加入MnSO4,除去过量的MnO4-。
考点:考查化学工艺及流程、涉及氧化还原反应、物质的分离提纯等。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:填空题
(1)硝酸是重要的工业原料。
①可用铝制容器存放浓硝酸的理由是 ;
②某硝酸厂处理尾气NO2的方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g) = 2H2O(g) △H=-483 kJ·moL-1
N2(g) + 2O2(g) = 2NO2(g) △H=+68 kJ·moL-1
则H2还原NO2生成水蒸气的热化学方程式是:
。
(2)某研究小组以CaCl2和H2为原料制备+1价Ca的化合物,产物中只有甲和乙两种化合物。研究发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为 ,甲与水反应可得H2,其化学方程式是: ;
②写出由CaCl2通过化合反应制备CaCl的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q_____184.8kJ(填“>”、“<”或“=”) 。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是____________。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l)。
CO(NH2)2 (l) + H2O (l)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)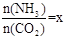 ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是___________。
(3)图中的B点处,NH3的平衡转化率为_______。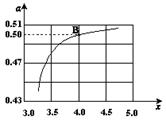
已知:3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
(4)完成并配平下列氧化还原反应方程式,再标出电子转移的方向和数目:
12Cl2+15NH3→ ――③
(5)反应③中的还原剂是 ,还原产物是 。
(6)若按③反应后产生气体9.408L(标准状况),则被氧化的气体的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式是 。
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,反应的离子方程是 。
(3)对比(1)和(2)实验所得的结果,将Cl 、I
、I SO2按还原性由强到弱顺序排列为 。
SO2按还原性由强到弱顺序排列为 。
II (4) 除去铁粉中混有铝粉的试剂是 ,离子方程式为
(5) 1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知氧化还原反应与四种基本反应类型的关系可用如图表示,下列是有水参加或生成的几种反应:
①CaO+H2O =Ca(OH)2
②2Na+H2O=2NaOH+H2↑
③H2+CuO  Cu +H2O
Cu +H2O
④3S+6NaOH  2Na2S +Na2SO3 +3H2O
2Na2S +Na2SO3 +3H2O
⑤NaOH+HCl=NaCl+H2O
请回答下列问题:
(1)反应①中水 (填字母)。
| A.是氧化剂 |
| B.是还原剂 |
| C.既是氧化剂又是还原剂 |
| D.既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁盐、亚铁盐是实验室常用的药品。根据题意完成下列填空:
(1)若向硫酸亚铁溶液中滴加稀硝酸,可以看到溶液逐渐变黄。为检验最后溶液中是否还有亚铁离子剩余,可以_____________________________________________;向已酸化的FeCl3溶液中逐滴加入Na2S溶液,有浅黄色沉淀生成,溶液逐渐变为浅绿色。写出该反应的离子方程式 。
(2)向FeSO4溶液中加几滴硫氰化钾溶液,无现象,再滴加H2O2,溶液变红,继续滴加H2O2,红色逐渐褪去,且有气泡产生。呈红色的物质是 (写化学式)。
已知:11H2O2+2SCN—→2SO42—+2CO2↑+ N2↑+10H2O +2H+若生成1mol N2,H2O2和SCN—的反应中转移电子物质的量是 mol。
(3)由以上实验,推断Fe2+、S2—和SCN—的还原性强弱 (按从强到弱顺序排列)。
(4)向FeCl3溶液中加入KOH溶液至过量,微热,再通入Cl2,可观察到溶液呈紫色(高铁酸钾:K2FeO4)。写出此过程的离子方程式、配平并标出电子转移的数目和方向 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
__C+__K2Cr2O7+__ →__CO2↑+ __K2SO4 + __Cr2(SO4)3+__H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中有利于增大该反应的反应速率的是 _______;
| A.随时将CH3OH与反应混合物分离 | B.降低反应温度 |
| C.增大体系压强 | D.使用高效催化剂 |
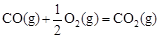 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1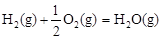 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
 CH3OH(g)的平衡常数K = 。
CH3OH(g)的平衡常数K = 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知制取氯气也可用浓盐酸与高锰酸钾为原料,其化学方程式为
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。请回答下列问题:
(1)用双线桥法标出该化学式电子转移的方向与数目:
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(2)反应中被还原的元素为 (写名称);标准状况下当生成112 L氯气时,反应中转移的电子数目为 。
(3)若有4 molHCl被氧化,则可生成标准状况下的氯气 L。
(4)若有1.58g高锰酸钾和100mL10moL/L浓盐酸充分反应(不考虑盐酸挥发,忽略溶液体积的前后变化),反应至终点时高锰酸钾紫色完全褪去,则被氧化的HCl的物质的量
为 mol。将反应后的溶液取出10mL,加入足量的硝酸银溶液,可得到沉淀的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钙是自然界存在最广泛的IIA族元素,常以化合物N存在。从钙单质起始发生的一系列化学反应可由下图表示: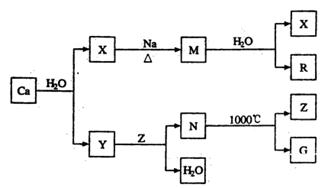
(1)钙元素在周期表中位于第______周期;Y中存在的化学键类型为_______________;N的化学式是______________。
(2)M与水反应的化学方程式为______________________________________________.
(3)Z和G的电子式分别为_______________________和_________________________.
(4)Z与R反应可能生成的盐有________________________________(填化学式)。
(5)实际生产中,可由N为原料制备单质钙,简述一种制备方法:
_________________________________________________________________________.
(6)金属钙线是炼制优质钢材的脱氧脱磷剂。某钙线的主要成分含Fe元素和Ca元素。
请配平下列用钙线脱氧脱磷的化学方程式: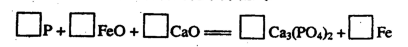
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com