
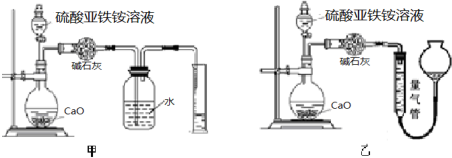
分析 (1)取20.00mL硫酸亚铁铵溶液于锥形瓶,用0.1000mol•L-1的酸性KMnO4溶液进行滴定发生反应为高锰酸钾溶液氧化亚铁离子为铁离子,结合电荷守恒和原子守恒书写离子方程式,利用高锰酸钾溶液的颜色变化判断反应终点;
(2)取20.00mL硫酸亚铁铵溶液加入氯化钡溶液生成硫酸钡沉淀,测定沉淀质量计算,亚铁离子具有还原性,易被氧化;检验亚铁离子的氧化产物铁离子;
(3)①根据氨气的溶解性和装置特点分析;
②选用该装置会导致测量值总是偏大一些,是因为装置内空气也被量到气体的体积中;
③根据氨气的体积计算氨气的物质的量,根据N守恒计算出硫酸亚铁铵的质量,进而计算质量分数.
解答 解:(1)酸性KMnO4溶液进行滴定发生反应时高锰酸钾溶液氧化亚铁离子为铁离子,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,判断达到滴定终点的依据是当最后一滴酸性高锰酸钾标准溶液滴入时,锥形瓶内溶液由黄色变为浅紫色,且半分钟内不再恢复原色,说明达到滴定终点,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;当最后一滴酸性高锰酸钾标准溶液滴入时,锥形瓶内溶液由黄色变为浅紫色,且半分钟内不再恢复原色,说明达到滴定终点;
(2)取20.00mL硫酸亚铁铵溶液加入氯化钡溶液生成硫酸钡沉淀,反应的离子方程式为:SO42-+Ba2+=BaSO4↓,亚铁离子具有还原性,易被氧化成铁离子,故测得硫酸亚铁铵浓度偏小;可检验亚铁离子的氧化产物铁离子,具体操作为:取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化;
故答案为:SO42-+Ba2+=BaSO4↓;Fe2+已被空气部分氧化;取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化;
(3)①氨气易溶于水,不能用排水法收集,甲装置中导管伸入液面下,易倒吸,用排水法,不合理;乙装置中导管在液面以上,符合排液体收集气体要求,量气管中液体应不能溶解氨气,氨气易溶于水和饱和碳酸钠溶液,难溶于四氯化碳,故用排四氯化碳法收集;
故答案为:乙;氨气极易溶于水,图一装置无法排液体,甚至会出现倒吸;c;
②选用乙装置会导致测量值总是偏大一些,原因是装置中的空气体积也被量气管量到生成气体的体积中,使测定结果偏大,
故答案为:装置内的空气被量出导致测量值偏大;
③VL氨气的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,m g硫酸亚铁铵样品中含N的物质的量为$\frac{500ml}{20ml}$×$\frac{V}{22.4}$mol=$\frac{25V}{22.4}$mol,
硫酸亚铁铵的纯度为:$\frac{\frac{25V}{22.4}mol×\frac{1}{2}×392g/mol}{mg}$×100%=$\frac{392V×500}{2×22.4m×20}$×100%,
故答案为:$\frac{392V×500}{2×22.4m×20}$×100%.
点评 本题考查制备实验方案的设计、物质性质、装置图的理解应用,综合性较强,注意结合题给信息和装置特点及物质的性质分析,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 盐酸能导电,所以盐酸是电解质 | |
| B. | 纯碱的化学式:NaOH | |
| C. | 碳酸钾的电离方程式:K2CO3=2K+1+CO3-2 | |
| D. | 氯离子的结构示意图为: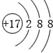 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与AlCl3溶液发生反应的离子方程式为Al3++3OH-═Al(OH)3↓ | |
| B. | 加水稀释,氨水的电离平衡向逆反应方向移动 | |
| C. | 用HNO3溶液恰好完全中和,中和后溶液不显中性 | |
| D. | 其溶液的pH=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不同的核素一定是不同的原子 | |
| B. | H2和D2互为同位素 | |
| C. | 所有主族元素的最高正化合价都等于其价电子数 | |
| D. | 所有的过渡元素都是金属元素,所有的金属元素也都是过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
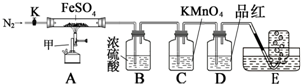 硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.
硫酸亚铁晶体(FeSO4•7H2O)俗称绿矾,加热至高温会分解.某化学研究小组利用如图装置探究FeSO4分解后的产物.| 实验 | 滴定管开始读数 | 滴定终点读数 |
| 1 | 0 | 19.98 |
| 2 | 0.10 | 20.12 |
| 3 | 0 | 20.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
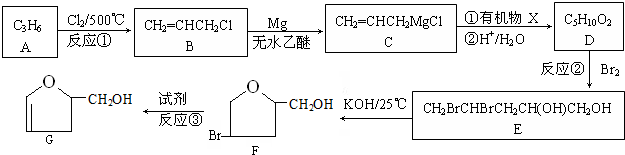
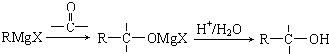
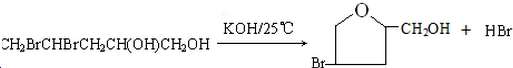 或
或 ;
;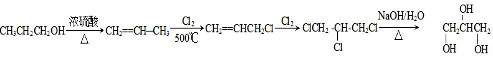 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
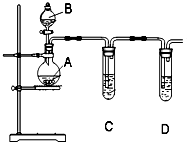 某化学实验小组选用图所示装置和下列所给试剂来证明非金属性:Cl>I.
某化学实验小组选用图所示装置和下列所给试剂来证明非金属性:Cl>I.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
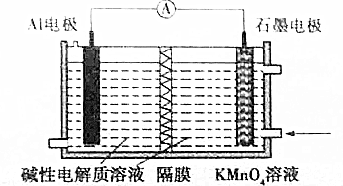
| A. | 溶液中OH-向石墨极移动 | |
| B. | A1电极附近溶液的pH保持不变 | |
| C. | 石墨极的电极反应式为MnO4-+3e-+4H═MnO2+2H2O | |
| D. | KMnO4中锰元素价态高,因此在同条件下放电容量比MnO2的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com