
����Ŀ����������ȼ���е�H2S�������ɼ��ٶԴ�������Ⱦ�����ɽ�����Դ�����á��ش��������⣺
��1��H2S��S��ȼ���������ʾ��
���� | ȼ����/��H��kJmol-1�� |
H2S | -a |
S | -b |

��д��������H2S��SO2��Ӧ���Ȼ�ѧ����ʽ______��
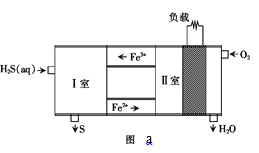
��2������H2S���Ϊһ��ȼ�ϵ�أ�ԭ����ͼa��ʾ�����У�Fe2+�ڵ�ع����е�������______����д�� I�ҷ��������ӷ���ʽ______��
��3��Ϊ̽��H2S��ֱ���Ƚ�2H2S��g��=2H2��g ��+S2��g������һ���Ϊ2L���ܱ������г���2 mol H2S��1 molAr ����ϡ�����ã�������ʵ�顣
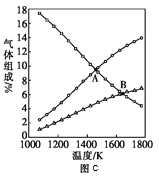
��ijͬѧ�����ͬ�¶���H2S�����ʵ����뷴Ӧʱ���ͼ��ͼb�ǽ�ȡ��ͼ����м�ij���֡������T2�¶��£�0-l0s�ڣ�H2S�ķ�Ӧ����v=______moL-1s-1��
��ͼb�У�T1��T2��T3�����¶ȣ���ߵ���______���Ƚ�A����B����淴Ӧ���ʵĴ�С��vA���棩______vB���棩����������������������=������
��ͼc�DZ�ʾ��Ӧ2H2S��g��=2H2��g��+S2��g��ƽ��ʱ��װ���ڸ�����������ʵ�������=���¶ȵĹ�ϵ������Ar����仯����δ������������㣺C���ƽ�ⳣ��K=______��D��ƽ��ʱ��H2S��ת����=______��
���𰸡�2H2S��g��+SO2��g��=3S��s��+2H2O��l����H=��-2a+3b��kJ/mol ���� 2Fe3++H2S=2Fe2++2H++S�� 0.04 T3 �� 0.25 66.7%
��������
��H2S��ȼ���Ȼ�ѧ����ʽ��H2S(g) +![]() O2(g)=SO2(g)+H2O(l) ��H= ��a kJ��mol-1��S��ȼ���Ȼ�ѧ����ʽ��S(s) +O2(g) =SO2(g) ��H=��bkJ��mol-1�������Ȼ�ѧ����ʽ�Ƶ�����Ӧ���ٸ��ݸ�˹��������H��
O2(g)=SO2(g)+H2O(l) ��H= ��a kJ��mol-1��S��ȼ���Ȼ�ѧ����ʽ��S(s) +O2(g) =SO2(g) ��H=��bkJ��mol-1�������Ȼ�ѧ����ʽ�Ƶ�����Ӧ���ٸ��ݸ�˹��������H��
��Fe2+�ڵ���г���ѭ�������ݴ����ص��жϣ�I��Fe3+��H2S����ΪS���ݴ���д����ʽ��
�Ǣٷ�Ӧ����Ϊ��λʱ����Ũ�ȵı仯��������ͼ��ʣ��1.2mol H2S�������ʼ�����ɼ���H2S�ķ�Ӧ���ʣ��ڸ������ȷ�Ӧ���¶�Խ�ߣ�ת����Խ�ߣ�����¶ȶԷ�Ӧ���ʵ�Ӱ�죬�¶�Խ�ߣ���Ӧ����Խ�ߣ�����֪H2S��ʼ����������仯��Ϊxmol���г�����ʽ���ڸ��ݲ�ͬ�����²�ͬ�������ʵ����Ĺ�ϵ���x��������C���ƽ�ⳣ��K��H2S��ת���ʡ�
��H2S��ȼ���Ȼ�ѧ����ʽ��H2S(g) +![]() O2(g)=SO2(g)+H2O(l) ��H=��a kJ��mol-1��S��ȼ���Ȼ�ѧ����ʽ��S(s) +O2(g) =SO2(g) ��H=��bkJ��mol-1�����ݸ�˹���ɣ�H2S��SO2��Ӧ���Ȼ�ѧ����ʽΪ��2H2S(g) +SO2(g) =3S(s) +2H2O(l)��H=(��2a+3b) kJ��mol-1���ʴ�Ϊ��2H2S(g) +SO2(g) =3S(s) +2H2O(l)��H=(��2a+3b) kJ��mol-1��
O2(g)=SO2(g)+H2O(l) ��H=��a kJ��mol-1��S��ȼ���Ȼ�ѧ����ʽ��S(s) +O2(g) =SO2(g) ��H=��bkJ��mol-1�����ݸ�˹���ɣ�H2S��SO2��Ӧ���Ȼ�ѧ����ʽΪ��2H2S(g) +SO2(g) =3S(s) +2H2O(l)��H=(��2a+3b) kJ��mol-1���ʴ�Ϊ��2H2S(g) +SO2(g) =3S(s) +2H2O(l)��H=(��2a+3b) kJ��mol-1��
��Fe2+�ڵ�ع����й�����ѭ�����ã���������û�иı䣬����Fe2+Ϊ������I�ҷ����ķ�ӦΪFe3+����H2S�����ӷ���ʽΪ��2Fe3++H2S=2Fe2++2H++S�����ʴ�Ϊ��2Fe3++H2S= 2Fe2++2H++S����
�Ǣ���ʼʱ����2molH2S������ͼ���֪10sʱʣ��1.2molH2S����![]() ���ʴ�Ϊ��0.04��
���ʴ�Ϊ��0.04��
�ڸ��ݷֽⷴӦһ��Ϊ���ȷ�Ӧ���¶�Խ�ߣ�ת����Խ�ߣ���T3�¶���ߣ�A����B������Ӧ�ĸ�����Ũ�Ⱦ���ͬ����A���Ӧ��T3��ߣ���Ӧ������Խϸߣ�����vA(��)��vB(��)���ʴ�Ϊ��T3������
��������ʼʱ2 molH2S����H2S�仯��Ϊxmol��������ʽ��
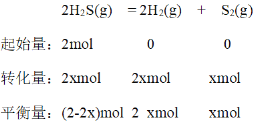
C��ʱ��ƽ��ʱH2S��H2�����ʵ���������ͬ����ƽ��ʱH2S��H2�����ʵ�����ͬ����2-2x=2x��x=0.5����ƽ��ʱc(H2S) = 0.5molL-1��c(H2)=0.5 molL-1��c(S2)=0.25 molL-1��ƽ�ⳣ��![]() ��D��ʱ��ƽ��ʱS2��H2S�����ʵ���������ͬ����ƽ��ʱS2��H2S�����ʵ�����ͬ����2-2x=x�����x=
��D��ʱ��ƽ��ʱS2��H2S�����ʵ���������ͬ����ƽ��ʱS2��H2S�����ʵ�����ͬ����2-2x=x�����x= ![]() ��H2S��ת����
��H2S��ת����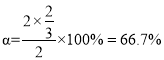 ���ʴ�Ϊ��0.25��66.7%��
���ʴ�Ϊ��0.25��66.7%��


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ��(ֻҪ�ɷ�CaSO4������SiO2��Al2O3��)Ϊԭ�Ͽ��Ʊ�����CaCO3��
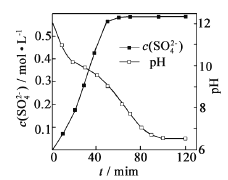
��1������������ͨ��CO2��������Һ��pH��c(SO42��)��ʱ��仯������ͼ����ҺpH>11ʱCaSO4ת�������ӷ���ʽ_____________���������ת�����ʵĴ�ʩ��____(�����)
A�����转�� | B�����Ƚ�����100�� |
C������ˮŨ�� | D����СCO2ͨ������ |
��2������ҺpH�ӽ�6��5ʱ�����˲�ϴ�ӹ��塣��Һ�����ʵ���Ũ����������������Ϊ______��________(�ѧʽ)������ϴ���Ƿ���ȫ�ķ�����_________��
��3���ڳ��������У���NH4Cl��Һ��ȡ�������յĹ��壬���Ž�ȡҺ�¶���������Һ��c(Ca2��)�����ԭ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() ��
��![]() ʱ��
ʱ��![]() ��
��![]() �ı�����Һ�У����������ӵ����ʵ���Ũ�ȵĸ�����
�ı�����Һ�У����������ӵ����ʵ���Ũ�ȵĸ�����![]() ����ҺpH�ı仯��ϵ��ͼ��ʾ������˵����ȷ����
����ҺpH�ı仯��ϵ��ͼ��ʾ������˵����ȷ����
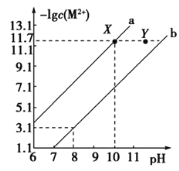
A.���Ũ�ȵ�![]() ��
��![]() �Ļ����Һ�еμ�
�Ļ����Һ�еμ�![]() ��Һ��
��Һ��![]() �ȳ���
�ȳ���
B.��![]() ��
��![]() ��������ʱ����Һ�У�
��������ʱ����Һ�У�![]()
C.Y���Ӧ��![]() ��ɢϵ�Dz��ȶ�����ϵ
��ɢϵ�Dz��ȶ�����ϵ
D.ͨ��ֱ�ӿ���pH�ķ����ɳ�ȥ![]() ��Һ�к��е���
��Һ�к��е���![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2���ǻ��춡������������ˮ����һ��Ӧ�����л��ϳɺ�ҩ������Ļ���ԭ�ϡ�

��1��2���ǻ��춡�������ķ���ʽΪ_________����ͬ��ѧ���������ں˴Ź�������ͼ���в�ͬ�����շ壬��2���ǻ��춡��������_________�����շ壻
��2���٢ڵķ�Ӧ���ͷֱ�Ϊ_________��_________��
��3����֪IΪ�������I��B�Ļ�ѧ����ʽΪ_________��
��4�����۲���F�Ľṹ��ʽΪ_________��
��5�������![]() ��
�� ��˵����ȷ����_________��˫ѡ������ĸ����
��˵����ȷ����_________��˫ѡ������ĸ����
A����������FeCl3��Һ����ɫ����ǰ�߲���
B�����߶�������NaHCO3��Һ��Ӧ�ų�CO2
C�����߶�����������������Һ������Ӧ�����������ʵ������ʱ�������������Ƶ��������
D�����߶����������������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�У����ǵ�ⱥ��ʳ��ˮ������ͭ�ĵ�⾫�������ǵ�ƣ��ش�

��1��b���ϵĵ缫��ӦʽΪ__����ص��ܷ�Ӧ��ѧ����ʽ��__��
��2���ڴ�ͭ�ĵ������У�ͼ��c�缫�IJ�����__�����ͭ�塱��ͭ�塱������d�缫�Ϸ����ĵ缫��ӦΪ__������ͭ�л�����Au��Ag��Fe�����ʣ�������ڵ��۵ײ��������ࣩ��������__�����һ��ʱ����Һ�еĽ���������__��
��3�����Ҫ������Ʒ�϶��������۽��������ԭ������59������f�缫�IJ�����__�������Ʒ�������顱����ͬ����e�缫�IJ�����__��
��4����e�缫�������仯118 g����a�缫�ϲ����������ڱ�״���µ����Ϊ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܻ���DEHP�������������˹��ɶ��ɣ���Σ��������ֳ��������ʹŮ�������죬���ڴ�����ȡ�ᵼ�¸ΰ����䶾��Զ���������谷�����������������ֳ���½������й����ܻ����ڱ��������������˵������ȷ���ǣ�������
A.����ʽΪC16H22O4������ʯ�ͻ���ԭ��ͨ��ȡ����������������Ӧ�Ƶ�
B.���л��������ܻ������������ö�����������ͨ�����˷�����ȥ
C.�ú˴Ź�����������6�����շ�
D.�ڱ���������������ܷ����ӳɣ�ȡ����������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��ȼ�Ϻ���̼���⡢������Ԫ�ء�Ϊ�˲ⶨ����ȼ����̼��������Ԫ�ص������ȣ��ɽ���̬ȼ�Ϸ���������O2��ȼ�գ���������������ȫ��ͨ����ͼ��ʾװ�ã��õ����±����е�ʵ����(���������������ȫ������)��
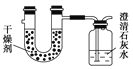
ʵ��ǰ | ʵ��� | |
�������U�ιܵ����� | 101.1 g | 102.9 g |
ʯ��ˮ���ƿ������ | 312.0 g | 314.2 g |
����ʵ��������գ�
(1)ʵ����Ϻ���������ˮ������Ϊ________ g��������ƿ������һ�����Σ�������Ϊ________ g��
(2)���ɵ�ˮ����Ԫ�ص�����Ϊ________ g��
(3)���ɵ�CO2��̼Ԫ�ص�����Ϊ________ g��
(4)��ȼ����̼����Ԫ�ص�������Ϊ________��
(5)��֪����ȼ�ϵ�ÿ�������к���һ����ԭ�ӣ����ȼ�ϵķ���ʽΪ________���ṹ��ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ��ͼ��ʾ�����й��ڸ��л����˵����ȷ����
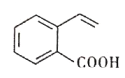
A. 1mol ���л��������4molH2��Ӧ����C9H16O2
B. ���л���������̼ԭ�Ӳ����ܴ���ͬһƽ����
C. ���л����ܷ����������ӳɡ�������ˮ��ȷ�Ӧ
D. ����л��������ͬ�����ŵ�ͬ���칹����3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ǹ��۵��������ҵ������Ҫ�ɷ�ΪFeWO4��MnWO4�ĺ��������봿���ұ���ٵ��������£�����˵������ȷ���ǣ� ��

A.��������������Ŀ��������Ӧ������
B.���۹����п���������������Fe(II)��Mn(II)
C.����II�ǹ��ˡ�ϴ�ӡ����H2WO4������ˮ�Ҳ��ȶ�
D.�ڸ�����WO3��������W
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com