
| A. | 将含1mol FeCl3的饱和氯化铁溶液逐滴加入沸水制备得到红褐色氢氧化铁胶体,其中含NA个Fe(OH)3胶粒 | |
| B. | 将80g NaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2 mol/L | |
| C. | 154g CCl4 在标准状况下的体积是22.4L | |
| D. | 在标准状况时,20ml NH3与60ml O2所含分子个数比为1:3 |
分析 A.氢氧化铁胶体微粒是氢氧化铁的粒子集合体;
B.溶液体积不是1L;
C.气体摩尔体积适用对象为气体;
D.同条件下,气体体积之比等于其分子数目之比.
解答 解:A.氢氧化铁胶体微粒是氢氧化铁的粒子集合体,将含1mol FeCl3的饱和氯化铁溶液逐滴加入沸水制备得到红褐色氢氧化铁胶体,其中含Fe(OH)3胶体粒子小于NA个,故A错误;
B.将80g NaOH溶于1L水中,溶液的体积大于1L,所得溶液中NaOH的物质的量浓度小于2 mol/L,故B错误;
C.标况下四氯化碳为液体,不能使用气体摩尔体积,故C错误;
D.同温同压下,气体体积之比等于其分子数目之比,故标准状况时,20mLNH3与60mL O2所含的分子个数比=20mL:30mL=1:3,故D正确;
故选:D.
点评 本题考查了摩尔质量、气体摩尔体积、阿伏伽德罗定律、溶液浓度和体积换算物质的量,题目难度不大,注意气体摩尔体积适用对象.


科目:高中化学 来源: 题型:选择题
| A. | 1010:1 | B. | 5×109:1 | C. | 108:1 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于金属元素 | |
| B. | 质子数与中子数之差为50 | |
| C. | 原子的核外电子数是39 | |
| D. | ${\;}_{39}^{49}$Y和${\;}_{39}^{50}$Y是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
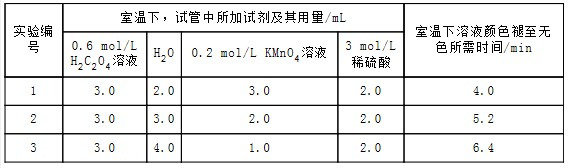
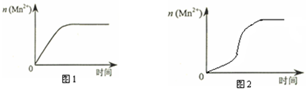
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA | |
| B. | 常温常压下,46gNO2与 N2O4的混合气体中含有的原子总数为3NA | |
| C. | 标准状况下,2.24LCl2与足量的稀NaOH溶液反应,转移电子总数为0.2NA | |
| D. | 1L 1 mol•L-1的盐酸中,所含氯化氢分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com