
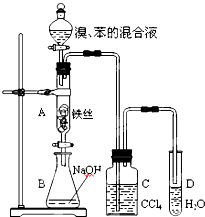
 某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.
某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.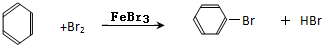 .
.| 向试管D中加入的试剂 | 能证明苯与液溴发生取代反应的现象 | |
| 方法一 | ||
| 方法二 |
分析 (1)苯和液溴在铁粉催化作用下发生取代反应生成溴苯和溴化氫;
(2)由于反应放热,苯和液溴均易挥发,
(3)溴能与氢氧化钠反应而溴苯不能,可以将溴苯中的溴除去;
(4)CCl4 能溶解溴不能溶解溴化氢,防止检验Br-或H+时Br2的干扰;
(5)溴化氫易溶于水电离出H+和Br-,通过检验H+或Br-证明.
解答 解:(1)在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成,
故答案为: ;
;
(2)由于反应放热,苯和液溴均易挥发,溴蒸气是一种红棕色的气体,
故答案为:反应液微沸,有红棕色气体充满A容器;
(3)A中的溴和氢氧化钠反应,可以将溴苯中的溴除去,
故答案为:除去溶于溴苯中的溴;
(4)根据相似相溶原理,溴极易溶于四氯化碳,而溴化氢则不溶,所以C中盛放CCl4的作用是除去溴化氢气体中的溴蒸气,
故答案为:除去溴化氢气体中的溴蒸气;
(5)如果发生取代反应,生成溴化氢,溴化氫易溶于水电离出H+和Br-,只要检验含有氢离子或溴离子即可,溴离子的检验:取溶液滴加硝酸银溶液,如果生成淡黄色沉淀就证明是溴离子;氢离子的检验:如果能使紫色石蕊试液变红,就证明含有氢离子,
故答案为:
| 向试管D中加入的试剂 | 能证明苯与液溴发生取代反应的现象 | |
| 方法一 | AgNO3 | 产生淡黄色沉淀 |
| 方法二 | 石蕊试液 | 溶液变红色 |
点评 本题考查的是苯的性质及离子的检验,解答四氯化碳的作用时从教材中找出原型--萃取实验,问题就容易解题答了.


科目:高中化学 来源: 题型:选择题
| A. | Cl2>Fe3+>I2>S | B. | Cl2>I2>Fe3+>S | C. | Cl2>Fe3+>S>I2 | D. | Fe3+>I2>C12>S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | B的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ba2+)浓度增大 | B. | 溶液中Ba2+数目减少 | ||
| C. | 溶液pH减小 | D. | 溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.4}{{t}_{1}}$mol.L-1.min-1 | |
| B. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 | |
| C. | 保持其他条件不变,若向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO和H2O的转化率均增大 | |
| D. | 保持其他条件不变,若起始时向容器中充入0.60mol CO和1.20 mol H2O,则到达平衡时,n(CO2)=0.40 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com