
| A. | 制备Fe(OH)3胶体:0.2 mol•L-1 FeCl3溶液与0.6 mol•L-1 NaOH溶液等体积混合 | |
| B. | 排除碱式滴定管尖嘴部分的气泡:将胶管弯曲使玻璃尖嘴端向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 | |
| C. | 测定浓度均为0.1mol•L-1 CH3COONa与HCOONa溶液的pH,不能比较CH3COOH与HCOOH酸性的强弱 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2ml5%H2O2和1mlH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
分析 A.氢氧化铁胶体制备:向沸水中滴加饱和的氯化铁溶液几滴,然后将溶液加热至红褐色为止;
B.将碱式滴定管的胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出,可排除尖嘴部分的气泡;
C.相同浓度的一元酸的钠盐,该溶液的pH越大,该酸的酸性越弱;
D.探究催化剂对双氧水分解速率的影响时,只有催化剂不同,其它条件必须完全相同.
解答 解:A.氢氧化铁胶体制备:向沸水中滴加饱和的氯化铁溶液几滴,然后将溶液加热至红褐色为止,将氯化铁溶液和NaOH溶液混合得到氢氧化铁沉淀而得不到胶体,故A错误;
B.将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出,从而溶液充满尖嘴,排除气泡,故B正确;
C.相同浓度的一元酸的钠盐,该溶液的pH越大,该酸的酸性越弱,所以可以根据相同浓度的CH3COONa与HCOONa溶液的pH,能比较CH3COOH与HCOOH酸性的强弱,故C错误;
D.探究催化剂对双氧水分解速率的影响时,只有催化剂不同,其它条件必须完全相同,在相同条件下,向一支试管中加入2ml5%H2O2和1mlH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,该实验催化剂不同,且其它条件相同,所以可以实现实验目的,故D正确;
故选BD.
点评 本题考查化学实验方案评价,为高频考点,涉及反应速率影响因素、酸性强弱比较、物质制备、仪器使用等知识点,明确实验原理、物质性质是解本题关键,同时还考查学生分析判断及比较能力,易错选项是A.


科目:高中化学 来源: 题型:选择题
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
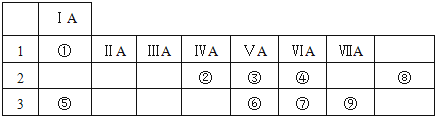
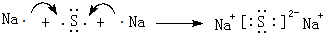 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合理使用化肥可以提高农作物的产量 | |
| B. | 生活中常使用热的纯碱溶液去除油污 | |
| C. | 明矾具有强氧化性,常用于自来水的杀菌消毒 | |
| D. | 船舶外壳装上锌块可以减缓其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{蒸发}{→}$无水AlCl3 | |
| B. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe | |
| C. | Al$\stackrel{NaOH(aq)}{→}$NaAlO2(aq)$\stackrel{△}{→}$NaAlO2(s) | |
| D. | Cu(OH)2 $\stackrel{HNO_{3}(ap)}{→}$Cu(NO3)2(aq)$\stackrel{蒸发}{→}$Cu(NO3)2晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 26.04 |
| 2 | 0.3000 | 2.00 | 25.02 |
| 3 | 0.3000 | 0.20 | 23.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
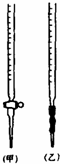 乙二酸俗称草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4•xH2O)中x的值.通过查阅资料该小组同学知道,草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应式为:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O
乙二酸俗称草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4•xH2O)中x的值.通过查阅资料该小组同学知道,草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应式为:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com