
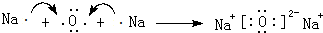 .
. 或
或 .
.
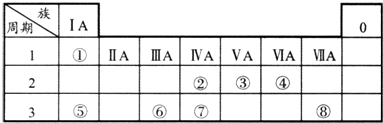
分析 由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)电子层结构相同,核电荷数越大离子半径越小;
(2)由于同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,最高价含氧酸的酸性越强;
(3)④和⑤的单质常温反应生成化合物A为Na2O,由钠离子与氧离子构成;
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO等;
(5)由①④两种元素形成常见液态化合物,该化合物可使酸性高锰酸钾溶液褪色,则该化合物为H2O2,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,反应生成锰离子、氧气与水;
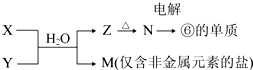
(6)M是仅含非金属的盐,所以M一定是铵盐,Z→N→⑥的单质,⑥为Al,推断N是氧化铝,Z是氢氧化铝,根据产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应;
根据2Al+3H2SO4=Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,计算生成氢气体积之比.
解答 解:由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,
故答案为:O2->Na+>Al3+;
(2)非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HNO3>H2CO3>H2SiO3 ,
故答案为:HNO3>H2CO3>H2SiO3 ;
(3)④和⑤的单质常温反应生成化合物A为Na2O,由钠离子与氧离子构成,用电子式表示形成过程为: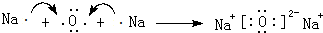 ,
,
故答案为: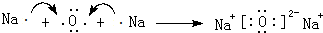 ;
;
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO等,对应的电子式为: 、
、 ,
,
故答案为: 或
或 ;
;
(5)(5)由①④两种元素形成常见液态化合物,该化合物可使酸性高锰酸钾溶液褪色,则该化合物为H2O2,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,反应生成锰离子、氧气与水,反应离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;
(6)M是仅含非金属的盐,所以M一定是铵盐,Z→N→⑥的单质,⑥为Al,推断N是氧化铝,Z是氢氧化铝,根据产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应,则X溶液与Y溶液反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
假设硫酸与氢氧化钠均为1mol,由2Al+3H2SO4=Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知生成氢气体积之比为1mol:1.5mol=2:3,
故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;2:3.
点评 本题考查元素周期表与元素周期律、元素化合物推断等,侧重对元素周期律与化学用语的考查,注意对元素周期表的整体把握,难度中等.


科目:高中化学 来源: 题型:选择题
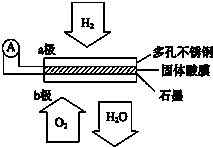 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )| A. | 电子通过外电路从b极流向a极 | |
| B. | b极上的电极反应式为:O2+2H2O+4e-=4OH- | |
| C. | 每转移0.1 mol电子,消耗标准状况下1.12 L的H2 | |
| D. | OH-由a极通过固体酸电解质传递到b极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClCH2=CH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH═CH2+NaCl | |
| B. | CH2=CHCH3+Cl2→CH2ClCHClCH3 | |
| C. | 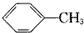 +Cl2$\stackrel{光照}{→}$ +Cl2$\stackrel{光照}{→}$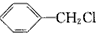 +HCl +HCl | |
| D. | 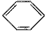 +HONO2$→_{△}^{浓硫酸}$ +HONO2$→_{△}^{浓硫酸}$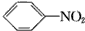 +H2O +H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17g OH-中含有的电子数为10 NA | |
| B. | 标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA | |
| C. | NA个Fe(OH)3胶体粒子的质量为107g | |
| D. | 44克14C16O2含氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
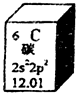 元素周期表是学习化学的重要工具,如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具,如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )| A. | 该元素的原子序数为6 | |
| B. | 该元素所有原子的质子数均为6 | |
| C. | 该元素的原子质量为12.01 g | |
| D. | 该元素应有多种同位素,所有原子的中子数不都为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 是离子化合物,含有离子键和共价键 | |
| B. | 电子式是: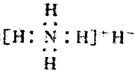 | |
| C. | 与水反应时,是还原剂 | |
| D. | 固体投入少量的水中,有两种气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 键能越大,键长越短,分子越稳定 | |
| B. | 同主族元素从上到下第一电离能减小 | |
| C. | 同周期主族元素从左到右,第一电离能都不断增大 | |
| D. | 共价键都有饱和性,但不一定都有方向性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com