
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法不正确的是( )
序号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
A | 碳酸氢钠粉末(Na2CO3) | H2O、CO2 | 加热结晶 |
B | 氯化钾溶液(FeCl3) | 氢氧化钾溶液 | 过滤 |
C | 乙烷气体(乙烯) | 溴水 | 洗气 |
D | 二氧化碳(二氧化硫) | 饱和NaHCO3溶液 | 洗气 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年浙江省高二下期中化学试卷(解析版) 题型:选择题
下列各组中两个变化所发生的反应,属于同一反应类型的是
①由乙醇制乙醛、由溴乙烷制乙烯
②乙烯使溴的四氯化碳溶液褪色、苯酚使溴水褪色
③由乙烯制聚乙烯、由异戊二烯制聚异戊二烯
④由油脂制肥皂、由淀粉制葡萄糖
A.只有②③ B. 只有③④ C.只有①③ D.只有①④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一下期中化学试卷(解析版) 题型:选择题
香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
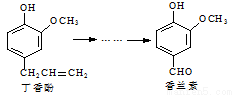
有关上述两种化合物的说法正确的是( )
A.常温下,1 mol丁香酚只能与1 molBr2反应
B.丁香酚不能与FeCl3溶液发生显色反应
C.1 mol香兰素最多能与3 mol氢气发生加成反应
D.香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一下期中化学试卷(解析版) 题型:选择题
二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不 能对二者进行鉴别的是( )
能对二者进行鉴别的是( )
A.利用铜丝燃烧法 B.利用质谱法 C.利用红外光谱法 D.利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期中化学试卷(解析版) 题型:选择题
有一无色透明溶液,可能含有下列离子:Al3+、Fe2+、Ba2+、NO3-、SO42—、Cl-、HCO3-,取该溶液做如下实验,则对该溶液的相关判断正确的是( )
实验步骤 | 实验现象 |
(1)取少量该溶液,加铜片和浓硫酸加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
(2)取少量该溶液,加BaCl2溶液 | 有白色沉淀产生 |
(3)取(2)中上层清液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于硝酸 |
(4)取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀溶解 |
A.一定含有NO3-、SO42—和Cl-
B.一定含有Al3+,可能含有Ba2+
C.一定含有NO3-、SO42—,可能含有HCO3-
D.一定不含Fe2+、Ba2+和HCO3-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期中化学试卷(解析版) 题型:选择题
下列操作能够达到目的的是( )
A.用湿润的pH试纸测定某溶液的pH
B.用25 mL碱式滴定管量取14.80 mL 1 mol/L NaOH溶液
C.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
D.用托盘天平称取25.20 gNaCl固体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期中化学试卷(解析版) 题型:选择题
下列做法不正确的是 ( )
A.使用、制备有毒气体应在通风橱中进行,应有尾气吸收处理装置
B.用湿润的红色石蕊试纸检验氨气
C.在50 mL量筒中配制0.100 0 mol·L-1碳酸钠溶液
D.汞洒落后,应立即撒上硫粉,并打开墙下面的排气扇
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江余姚中学高一实验班下期中化学试卷(解析版) 题型:选择题
下列关于常见有机化合物的说法中,不正确的是
A.甲烷和氯气反应生成一氯甲烷,苯和硝酸反应生成硝基苯,两者的反应类型相同
B.分子式为C5H12的有机物只有三种,它们互为同系物
C.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有碳碳双键
D.葡萄糖是人体内主要供能物质,血液中葡萄糖含量过低,会使人患“低血糖”症
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆一中高二下第二次段考化学试卷(解析版) 题型:简答题
I.已知:反应
4HCl(g)+O2(g)  2Cl2(g)+2H2O(g) ΔH = —115.6 kJ/mol
2Cl2(g)+2H2O(g) ΔH = —115.6 kJ/mol
H2(g) + Cl2(g) = 2HCl(g) ΔH = —184 kJ/mol
H2O(g) = H2O(l) ΔH = —44 kJ/mol
写出H2燃烧热的热化学方程式 。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: ,它所对应的化学方程式为:
,它所对应的化学方程式为:
(2)在一定体积的密闭容器中,进行如下化学反应:
A(g) + 3B(g) 2C(g) + D(s) ΔH,其化学平衡常数K与温度T的关系如下表:
2C(g) + D(s) ΔH,其化学平衡常数K与温度T的关系如下表:
T/K | 300 | 400 | 500 | … |
K/(mol·L-1)2 | 4×106 | 8×107 | K1 | … |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)已知N2 (g)+ 3H2(g) 2NH3(g) △H<0
2NH3(g) △H<0
①在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为: ,用氮气表示的反应速率为: 。
②保持①中的温度和容积不变,设a、b、c分别代表初始加入的N2、H2、NH3的物质的量,若反应达平衡后,混合气体中NH3的体积分数与①中的相同,那么: 若a= 0.5,c= 3,则b= ,在此情况下反应起始时将向 反应方向进行。
③保持①中的温度和容积不变,若按下列四种配比作为起始物质,达平衡后容器内N2的转化率大于①中的是 。(填序号)
A.4molNH3 B.1.5molN2、7.5molH2和1molNH3
C.1molN2、5molH2和2molNH3 D.1molN2、6molH2和2molNH3
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。
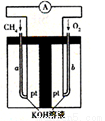
①放电时,负极的电极反应式为 。
②假设装置中盛装100.0 mL 3.0 mol·L-1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8960 mL。放电完毕后,电解质溶液中的溶质是 电解质溶液中各离子浓度的大小关系为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com