
【题目】下列叙述中正确的是( )
A.钢铁发生电化学腐蚀时,正极上发生的反应为 Fe-2e-=Fe2+
B.用惰性电极分别电解熔融的NaCl和饱和食盐水时,阳极的电极反应式均为:2Cl- -2e-=Cl2↑
C.铜锌原电池工作时,若有13 克锌被溶解,外电路就有0.2 mol电子通过
D.电解精炼铜时,粗铜作阳极,纯铜作阴极,硫酸铜溶液作电解质溶液
【答案】BD
【解析】
A. 钢铁发生电化学腐蚀时,负极上Fe失去电子,发生氧化反应,电极反应式为为Fe-2e-=Fe2+,A错误;
B. 用惰性电极电解熔融NaCl时,阴极上发生反应:2Cl- -2e-=Cl2↑;用惰性电极电解饱和食盐水时,由于阴离子放电能力Cl->OH-,所以阴极上发生反应:2Cl- -2e-=Cl2↑,B正确;
C. 13 g Zn的物质的量为n(Zn)=![]() =0.2 mol,由于Zn是+2价金属,所铜锌原电池工作时,若有13 g锌被溶解,外电路就会有0.2 mol×2=0.4 mol电子通过,C错误;
=0.2 mol,由于Zn是+2价金属,所铜锌原电池工作时,若有13 g锌被溶解,外电路就会有0.2 mol×2=0.4 mol电子通过,C错误;
D. 电解精炼铜时,要以粗铜作阳极,纯铜作阴极,含有Cu离子的溶液如硫酸铜溶液作电解质溶液,D正确;
故合理选项是BD。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
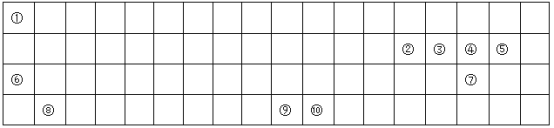
请回答下列问题:
(1)在表中画出元素周期表前四周期的边框______。
(2)表中属于d区的元素符号为________,其基态原子的价层电子排布图为__________。
(3)元素①与②形成的一种化合物是重要的化工原料,常把该物质的产量作为衡量石油化工发展水平的标志。有关该分子的说法正确的是_____ 。
A.分子间存在氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该分子中,中心原子采用sp2杂化
(4)①、③、④、⑦、⑩五种元素形成的一种常见的深蓝色配合物, 其化学式为_____________
1摩尔配合离子所含σ键个数为__________,配体分子的空间构型为_______ ;与该配体分子互为等电子体的阳离子的符号为___________。
(5)③、④、⑥三种元素第二电离能从小到大依次为:___________(用元素符号填空)。
(6)元素⑩的焰色为绿色,很多金属元素能形成焰色反应的原因为_________________。
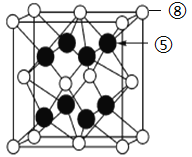
(7) ⑧与⑤形成离子化合物的晶胞结构如图所示。可以用____________方法区分晶体和非晶体。该晶胞中,⑧离子的配位数为_____________;若晶体的密度为ag·cm-3,阿伏加德罗常数的值为NA,则晶胞中最近的两个⑤离子间距离为_________________pm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,针对表中的①~⑥元素,回答下列问题
主族 周期 | ⅠA | 0族 | ||||||
一 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
二 | ② | |||||||
三 | ③ | ④ | ⑤ | ⑥ | ||||
(1)最活泼的金属元素是_______________(填元素符号)
(2)②和⑤两种元素原子半径较大的是_______________(填元素符号),⑤和⑥两种元素最高价氧化物对应的水合物酸性较强的是_____________(填元素符号);
(3)写出①的单质在⑥的单质中燃烧的化学方程式_______________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z均为元素周期表中前20号元素,X和Z位于同一周期,Y的阳离子和Z的阴离子的核外电子排布相同,Y2Z2与H2Z或XZ2反应都能生成单质气体Z2。
(1)写出元素名称:X________,Y________,Z________。
(2)写出下列物质的电子式:Y2Z2__________________,XZ2__________________。
(3)用电子式表示Y2Z的形成过程:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 14g乙烯和丙烯的混合物中极性键数目为2NA
B. 标准状况下,![]() 与
与![]() 在光照条件下反应生成HCl分子数为
在光照条件下反应生成HCl分子数为![]()
C. 容器中2molNO与1molO2充分反应,产物的分子数为2NA
D. 电解精炼铜时阳极减轻32 g,电路中转移电子数目一定为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在乙醇的化学性质中,各反应的断键方式可概括如图:
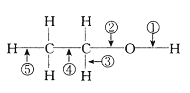
用序号填空:
(1)消去反应的断键位置是___________,化学方程式为________________。
(2)与金属Na反应的断键位置是___________,化学方程为________________。
(3)催化氧化的断键位置是________________,化学方程为_______________。
(4)分子间脱水的断键位置是___________,化学方程为________________。
(5)与HBr反应的断键位置是_______________,化学方程为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为___________,铬元素在周期表中___________区。
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为___________杂化。

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___________填元素符号
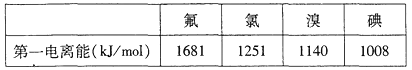
②根据价层电子对互斥理论,预测ClO3-的空间构型为___________形,写出一个ClO3-的等电子体的化学符号___________。
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?___________(填“是”或“否”);该立方体是不是Fe3O4的晶胞?___________(填“是”或“否”);立方体中铁离子处于氧离子围成的___________(填空间结构)空隙;根据上图计算Fe3O4晶体的密度为___________g·cm-3。(图中a=0.42nm,计算结果保留两位有效数字)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO

(1)试剂X为___________________________。
(2)请将提供的装置按合理顺序连接。g→_______________________。
(3)装置B的作用是_______________________。
(4)证明NH3能还原CuO的实验现象是_______________________。
II.探充还原产物的成分
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为_________。 |
若溶液变蓝 | ②证明红色固体肯定含有______,可能含有__________。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量__________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用离子方程式回答下列问题:
(1)泡沫灭火器中灭火原理(内装小苏打溶液和![]() 溶液____________。
溶液____________。
(2)已知AgCl为难溶于水和酸的白色固体,![]() 为难溶于水和酸的黑色固体。向AgCl的悬浊液中加入足量的
为难溶于水和酸的黑色固体。向AgCl的悬浊液中加入足量的![]() 溶液并振荡,白色固体完全转化为黑色固体:________________。
溶液并振荡,白色固体完全转化为黑色固体:________________。
(3)③实验室配制![]() 溶液,溶解时先要加入少量的稀硫酸,其原因________;配制完毕后要加入少量铁屑,其目的是_____________。
溶液,溶解时先要加入少量的稀硫酸,其原因________;配制完毕后要加入少量铁屑,其目的是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com