
分析 (1)根据化学式知,n(H+)=2n(H2SO4)、n(SO42-)=n(H2SO4),硫酸分子个数=nNA;
(2)根据分子构成知,要使CO和CO2中O原子个数相等,则二者的物质的量之比为2:1;
(3)每个水分子中含有3个原子,原子物质的量=3n(H2O).
解答 解:(1)根据化学式知,n(H+)=2n(H2SO4)=2×1.5mol=3mol、n(SO42-)=n(H2SO4)=1.5mol,硫酸分子个数=nNA=1.5mol×NA/mol=1.5NA,
故答案为:3mol;1.5mol;1.5NA;
(2)根据分子构成知,要使CO和CO2中O原子个数相等,则二者的物质的量之比为2:1,则二氧化碳物质的量=$\frac{1}{2}$×n(CO)=$\frac{1}{2}$×1mol=0.5mol,故答案为:0.5;
(3)每个水分子中含有3个原子,原子物质的量=3n(H2O)=3×0.5mol=1.5mol,
故答案为:1.5.
点评 本题考查物质的量有关计算,为高频考点,明确各个物理量之间关系及分子构成是解本题关键,题目难度不大.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③⑤ | C. | ①②⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲~己元素在周期表中的相对位置如图.甲是形成化合物种类最多的元素,乙比甲原子序数多6,丁、戊、己属同周期元素,下列判断错误的是( )
甲~己元素在周期表中的相对位置如图.甲是形成化合物种类最多的元素,乙比甲原子序数多6,丁、戊、己属同周期元素,下列判断错误的是( )| A. | 乙的单质在空气中燃烧生成的化合物只含离子键 | |
| B. | 丙可作半导体材料 | |
| C. | 丁与已核外电子数相差12 | |
| D. | 戊和己都不是主族元素,而是过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
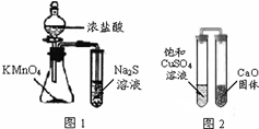
| A. | 下列有关实验原理、操作或现象不正确的是图1锥形瓶中滴入浓盐酸后充满黄绿色气体,试管中出现浅黄色浑浊 | |
| B. | 图2放置一段时间后,饱和CuSO4溶液中出现白色晶体 | |
| C. | 用玻璃棒蘸取某溶液做焰色反应实验,火焰呈黄色说明该溶液中不含钾元素 | |
| D. | 蒸馏时,将温度计水银球靠近蒸馏烧瓶支管口处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W 与Y 可以形成离子化合物 | |
| B. | X 的简单氢化物在同主族元素的氢化物中沸点最高,说明X 的非金属性最强 | |
| C. | X 和Z 形成的原子个数l:1 的化合物中,既含有极性键又含有非极性键 | |
| D. | 工业生产中,通常用电解Z 的熔融氧化物来制取Z 的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | 只有②③ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com