
【题目】“安全无小事,安全人人有责。”下列关于安全问题的说法不正确的是( )
A.辨认化学药品时,做到三不“不直接闻、不品尝、不触摸”
B.氢气还原氧化铜实验开始时,先点灯加热后再通入氢气
C.金属钠着火可以用干沙土掩埋灭火
D.少量烧碱蘸在手上时,快速用水冲洗,然后涂上硼酸溶液进行中和
科目:高中化学 来源: 题型:
【题目】根据题目要求,回答下列问题。
(1)选择下面的实验装置完成相应的实验:

实验室制取乙烯用到的装置是_____________(填写序号,下同);分离苯和甲苯用到的装置是__________________;提纯苯甲酸过程中进行分离操作用到的装置是__________________;用CCl4萃取溴水中的溴用到的装置是__________________;
(2)以下是五种常见有机物分子模型示意图,其中A、B、C为烃,D、E为烃的含氧衍生物。

鉴别A和B的试剂为__________________;上述物质中有毒、有特殊气味,且不溶于水、密度比水小的液体是____________(填名称);D分子中的官能团的结构简式是_______________;检验E中的官能团可以选用的试剂是______________________。
(3)写出下列化学方程式:
 与足量溴水反应_____________________________________;
与足量溴水反应_____________________________________; 与足量NaOH溶液反应_____________________________________。
与足量NaOH溶液反应_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①氢氟酸; ②浓H2SO4;③NaOH溶液;④Na2CO3固体;⑤氧化钙;⑥ 浓HNO3,其中在一定条件下能与SiO2反应的有( )
A. ①②⑥B. 全部C. ①③⑤D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是硫的重要化合物,在生产、生活中有广泛应用,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如图所示:

(1)写出由铜和浓硫酸制取SO2的化学方程式_______________________________。
(2)装置A中的现象是__________________________________________________。反应结束后若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在蒸发操作中要用到的主要仪器有_______(填编号)。自然干燥晶体而不烘干晶体的原因是___________________________。
A.酒精灯 B.蒸发皿 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(3)根据以上现象,该小组同学认为SO2与FeCl3发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式__________________________;
②请设计实验方案检验有Fe2+生成__________________________;
(4)B中蓝色溶液褪色,表明SO2的还原性比I-_________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是( )
A. 过滤操作时,用玻璃棒搅拌漏斗内的液体,以加速过滤
B. 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C. 萃取操作时,可以选用CCl4或酒精作为萃取剂从碘水中萃取碘
D. 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从上口放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 2.0 g重水(2H2O)中含有的质子数为10NA
B. 50mL 18.4 molL-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
C. 分子数为NA的N2、C2H4混合气体体积约为22.4 L,质量为28 g
D. 标准状况下,22.4LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置)

实验步骤:
(1)按如图所示组装好装置后,应先__________ (填操作名称)。仪器B和D的作用是________,按图示加入试剂,E中的试剂是_____________(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。C中反应生成Na2S2O3和CO2,写出A中反应的化学方程式为_______,C中反应的离子方程式为_________。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经_______(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,过滤,洗涤,____________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验Ⅱ步骤(2)进行了改进,改进后的操作是______。
(3)探究Na2S2O3是否具有还原性:向新制氯水中滴加Na2S2O3溶液,若看到_____________,
说明有还原性 (已知:Na2S2O3被氧化成Na2SO4),反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验仪器的说法正确的是( )
A.精确度为0.1的仪器:托盘天平、量筒、容量瓶
B.都需要使用玻璃棒的实验操作:蒸发、过滤、萃取、蒸馏、稀释浓硫酸
C.使用时需要检漏的仪器:容量瓶、分液漏斗
D.可以直接加热的仪器:蒸发皿、坩埚、表面皿、蒸馏烧瓶、容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作或装置能达到实验目的是( )
A.  验证NaHCO3和Na2CO3的热稳定性 B.
验证NaHCO3和Na2CO3的热稳定性 B. 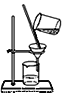 分离Fe(OH)3胶体
分离Fe(OH)3胶体
C.  称取一定量的NaOH D.
称取一定量的NaOH D.  制取NaHCO3
制取NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com