
分析 (1)题给信息可知,Fe2+开始沉淀时,Cu2+已经沉淀完全,而Fe3+沉淀完全时,Cu2+未沉淀,故除去溶液中Fe2+,应先加入氧化剂,将Fe2+氧化为Fe3+沉,再调节溶液pH,注意不能引入杂质离子;
(2)NaClO为强碱弱酸盐,水解呈碱性,则加入NaClO,溶液的pH一定增大,另外NaClO可以酸反应生成HClO而导致溶液pH增大,氧化亚铁离子时会有氢离子参加,也导致溶液pH增大;
(3)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质;
(4)根据关系式:lgc(Cu2+)=8.6-2pH计算溶液pH,再结合pH≥3.7时Fe3+沉淀完全判断;
(5)亚铁离子的还原性大于溴离子,氯气不足时亚铁离子优先被氧化,剩余的氯气再氧化溴离子,据此写出反应的离子方程式.
解答 解:(1)题给信息可知,Fe2+开始沉淀时,Cu2+已经沉淀完全,而Fe3+沉淀完全时,Cu2+未沉淀,故除去溶液中Fe2+,应先加入氧化剂,将Fe2+氧化为Fe3+沉,再调节溶液pH,具体方法为:向溶液中加入足量过氧化氢或氯水,充分反应后,调节pH在3.7~4.4之间,最后过滤,
故答案为:向溶液中加入足量过氧化氢或氯水,充分反应后,调节pH在3.7~4.4之间,最后过滤;
(2)NaClO为强碱弱酸盐,水解呈碱性,则加入NaClO,溶液的pH一定增大,另外NaClO可以酸反应生成HClO而导致溶液pH增大,氧化亚铁离子时会有氢离子参加,也导致溶液pH增大,
故答案为:增大;
(3)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质,则则可用CuO 或Cu(OH)2或CuCO3,
故答案为:CuO 或Cu(OH)2或CuCO3;
(4)若溶液中c(Cu2+)为1mol/L,根据关系式:lgc(Cu2+)=8.6-2pH,可知溶液pH=4.3,pH≥3.7时Fe3+沉淀完全,故溶液中Fe3+沉淀完全,
故答案为:4.3;能;
(5)标况下,2.24L氯气的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,2L0.05mol/L的FeBr2溶液中含有溴化亚铁的物质的量为:0.05mol/L×2L=0.1mol,通入氯气后,
0.1mol亚铁离子优先反应消耗0.05mol氯气,剩余的0.05mol氯气完全反应氧化0.1mol溴离子,即只有一半的溴离子被氧化,该反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,
故答案为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-.
点评 本题考查实验方案设计、物质分离提纯、离子方程式的书写等知识,题目难度中等,注意根据离子开始沉淀与沉淀完全的pH进行分析解答,侧重考查学生对数据的分析与迁移应用.


科目:高中化学 来源: 题型:选择题
| A. | 反应前酸、碱溶液的温度要相同 | |
| B. | 环形玻璃棒搅拌能加快反应速率,减小实验误差 | |
| C. | 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) | |
| D. | 为了使反应更完全,可以使酸或碱适当过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
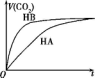 等体积、浓度均为0.2mol•L-1的三种溶液:①HA溶液、②HB溶液、③NaHCO3溶液,已知将①②分别与③混合,实验测得所产生的CO2气体体积(V)随时间(t)变化如图所示.下列说法不正确的是( )
等体积、浓度均为0.2mol•L-1的三种溶液:①HA溶液、②HB溶液、③NaHCO3溶液,已知将①②分别与③混合,实验测得所产生的CO2气体体积(V)随时间(t)变化如图所示.下列说法不正确的是( )| A. | 酸性:HB>HA>H2CO3 | |
| B. | 反应结束后所得两溶液中:c(A-)>c(B-) | |
| C. | 上述三种溶液中由水电离的c(OH-)相对大小:NaHCO3>HA>HB | |
| D. | HA溶液和NaHCO3溶液反应所得的溶液中:c(A-)+c(HA)=0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
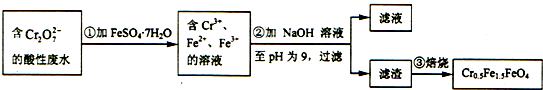
| A. | 根据第①步反应可知还原性:Cr3+大于Fe2+ | |
| B. | 第②步过滤得到的滤渣中主要成分为Cr(OH)3、Fe(OH)2,不含Fe(OH)3 | |
| C. | 欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需要加入27.8g FeSO4•7H2O | |
| D. | 第③步高温焙烧过程用到的主要实验仪器中属于硅酸盐质的有:酒精灯、蒸发皿、泥三角 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
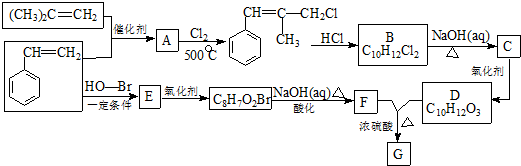
 .
.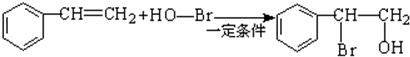 .
.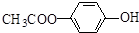 和
和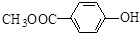 .
.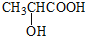 ) 的合成路线:
) 的合成路线: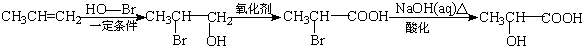 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
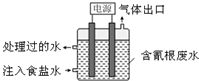 某些工业废水中常是含有氰根(CN-)的无机物,有一定的毒性,有的还是剧毒.图所示装置是工业上采用的电解法除去含CN-废水的装置.工作时控制溶液为碱性,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列叙述不正确的是( )
某些工业废水中常是含有氰根(CN-)的无机物,有一定的毒性,有的还是剧毒.图所示装置是工业上采用的电解法除去含CN-废水的装置.工作时控制溶液为碱性,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列叙述不正确的是( )| A. | 用石墨作阴极,铁作阳极 | |
| B. | 阴极的电极反应式为:2H2O+2e-=H2↑+2OH- | |
| C. | 阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O | |
| D. | 除去CN-的反应:2CN-+5ClO-+H2O=N2↑+2CO2↑+5Cl-+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com