
����Ŀ������ѧ��ѡ��2����ѧ�뼼������ú����ȼú�糧�ų�����Ҫ�������ҹ���糧��ú�ҵ���Ҫ���������Ϊ��SiO2��Al2O3��CaO�ȡ�һ�����÷�ú����ȡ�������Ĺ����������£�
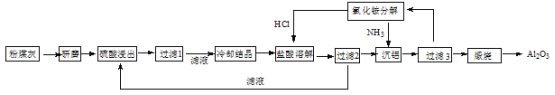
��1����ú����ĥ��Ŀ���� ��
��2����1�ι�����������Ҫ�ɷ��� �� ���ѧʽ, ��ͬ��,��3�ι���ʱ�������ijɷֵ��� ��
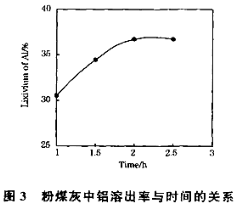
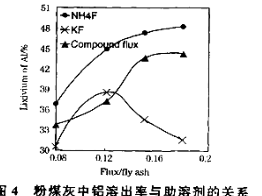
��3����104���������ȡʱ�����Ľ�ȡ����ʱ��Ĺ�ϵ����ͼ1�����˵Ľ�ȡʱ��Ϊ h�����Ľ�ȡ���롰���ܼ�/��ú�ҡ��Ĺ�ϵ��ͼ2��ʾ���ӽ�ȡ�ʽǶȿ��ǣ��������ܼ�NH4F��KF����NH4F��KF�Ļ��������ܼ�/��ú����ͬʱ����ȡ����ߵ��� ���ѧʽ�����ú����Ļ��������������ܼ�ȱ���� ����һ������
��4��������ѭ��ʹ�õ������� �� ���ѧʽ����
��5���������ܽ����������壬�ܹ�������ԭ���� ��
��6���÷�ú����ȡ�������������Ҫ������ ��
���𰸡���1����С���ȣ�����Ӵ��棬��߽�ȡ���ʺͽ�ȡ�ʣ�2�֣�
��2��SiO2��1�֣���CaSO4 ��1�֣���Al(OH)3��1�֣�
��3��2��1�֣���NH4F��1�֣������ɹ����в���HF��NH3����Ⱦ������2�֣�
��4��H2SO4��1�֣���NH4Cl��1�֣�
��5��ͨ��HClʹAlCl3��6H2O���ͣ���Al2(SO4)3�����ͣ�2�֣�
��6��ʹ����������Դ�����ã�2�֣�
��������
�����������ú�ҵ���Ҫ���������ΪSiO2��Al2O3��CaO�ȣ�����������ҺʹAl2O3�ܽ⣬CaOͨ����Ӧ����CaSO4��CaSO4�ܣ���CaSO4��SiO2һ���Ϊ���������˺���Һ��ȴ�ᾧ��Al2��SO4��3���������ܽ�Al2��SO4��3����ͨ���Ȼ����AlCl36H2O�����������Һ�����˵�������Һ������ѭ�����ã�AlCl36H2O�����ܽ����Ȼ�����Һ��ͨ�백�������������������Ȼ����Һ���Ȼ����Һ����ѭ�����ã����������������ȷֽ�����Al2O3��
��1����ú����ĥ��Ŀ������С���ȣ�����Ӧ��ĽӴ��������߽�ȡ���ʺͽ����ʣ�
��2��ͨ�����Ϸ�����֪����1�ι���ʱ��������Ҫ�ɷ���SiO2�� CaSO4����3�ι���ʱ�����ijɷ���Al��OH��3��
��3������ͼ1��֪��2hʱ���Ľ����ʴﵽ���ֵ���������˵Ľ�ȡʱ��Ϊ2h������ͼ2��֪����n(���ܼ�)/n(��ú��)��ͬʱ��NH4F���ܼ������Ľ�������ߣ��ú����Ļ��������������ܼ���ȱ�������������л������Ⱦ������HF��NH3�ȣ�
��4����������ķ�����֪��������ѭ��ʹ�õ�������H2SO4��NH4Cl��
��5���������ܽ����������壬��ͨ��HCl���壬����AlCl36H2O���ù����ܹ�������ԭ����ͨ���Ȼ���ʹAlCl36H2O�ﵽ���ͣ��������������ͣ�����AlCl36H2O��������
��6���÷�ú����ȡ�������������Ҫ��������ʹ����������Դ�����á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪NO2��N2O4�ת����2NO2��g��![]() N2O4��g������H=��24.2kJ/mol���ں����£���һ����NO2��N2O4��g���Ļ������������Ϊ2L���ܱ������У��������ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼ���������������������ǣ� ��
N2O4��g������H=��24.2kJ/mol���ں����£���һ����NO2��N2O4��g���Ļ������������Ϊ2L���ܱ������У��������ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼ���������������������ǣ� ��
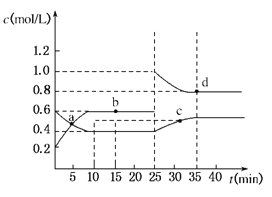
A��a��b��c��d�ĵ���V����V�������
B����Ӧ���е�10minʱ����ϵ���յ�����Ϊ9.68kJ
C��ǰ10min�ڣ���v��NO2����ʾ�ĸ÷�Ӧ����Ϊ0.02mol/Lmin
D��25minʱ������ƽ���ƶ���ԭ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��![]() ��̼��������Ĺ�ҵ����ԭ������ͼ��Ͷ�ϱ�[
��̼��������Ĺ�ҵ����ԭ������ͼ��Ͷ�ϱ�[![]() ]�ֱ�Ϊ3:1��1:1����Ӧ��������ʵ�����ͬʱ��
]�ֱ�Ϊ3:1��1:1����Ӧ��������ʵ�����ͬʱ��![]() ��ƽ��ת�������¶ȵĹ�ϵ����������˵����ȷ����
��ƽ��ת�������¶ȵĹ�ϵ����������˵����ȷ����
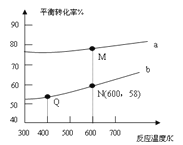
A������b����Ӧ��Ͷ�ϱ�Ϊ3:1
B��M���Ӧ��ƽ�ⳣ��С��Q��
C��N���Ӧ��ƽ��������̼������������ʵ�������Ϊ0.58
D��M���Q���Ӧ��ƽ��������������ʵ���֮��Ϊ2:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��DDT�ֽеε��飬��ѧ��Ϊ˫���ȱ����������飬��ѧʽ(ClC6H4)2CH(CCl3)�����ƴ�Ӣ����дDDT������Ϊ��ɫ���壬������ˮ������ú�ͣ����Ƴ����������Ч��ɱ�����DDT����ʳ�������ǵ���һЩʳ���ʳ�����ӽ��������Ҫԭ����˴�70�����ε�����������������ֹ������ʹ�á���ṹΪ��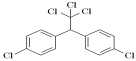 �������й�˵����ȷ���� ( )
�������й�˵����ȷ���� ( )
������̼ԭ��Ϊ����̼ԭ��������4��ԭ�ӻ�ԭ���Ų�ͬ��
A���������� B��DDT��ȫȼ�պ�ֻ����CO2��H2O��������
C������������̼ D����˴Ź�����ͼ����5��λ�÷�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A����ͨ����ͬ�ķ�Ӧ�õ�B��C:
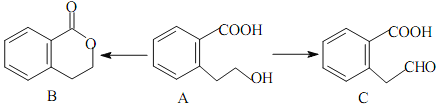
��1��A�ķ���ʽΪ_________________��C�ĺ�������������Ϊ_________________��
��2��A��ȡC���л���Ӧ����Ϊ_________________��A��ȡB�Ļ�ѧ����ʽΪ��_________________��
��3��A������ȥ��Ӧ�����Ľṹ��ʽΪ_________________��A������һ�������̼ԭ����_________________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��10�£���ӴӴ���ŵ��������ѧ��ҽѧ�����������������������أ�����ҩƷ������Ч����ű�����ߵ������ʣ�����Ϊ���ѧ��ŵ���������й��ˡ������������ɺϳɵõ�����ű����ҩ�����������������й�˵����ȷ����( )
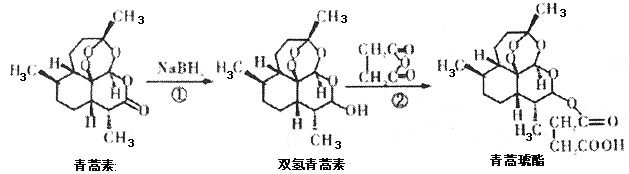
A�������ط���ʽΪC15H24O5
B����Ӧ��ԭ��������Ϊ100%
C���ù���������������˫������������������Ӧ
D��1 mol��������������������Һ��Ӧ���������1 mol��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�о����ʲ�������Ũ����ķ�Ӧ��ijѧϰС����̼�ظ�(����CԪ��0.03%~2.0%���Ͻ�)����������̽�����
[̽��һ]
��1������ȥ�����������������������Ũ�����У�10���Ӻ���������ͭ��Һ�У�Ƭ�̺�ȡ���۲죬�������������Ա仯����ԭ����____��
��2��ȡ̼�ظ�6.0 g��15.0 mLŨ�����У����ȣ���ַ�Ӧ��õ���ҺX���ռ����������Y��
�ټ�ͬѧ��ΪX�г�Fe3���������Fe2������Ҫȷ�����е�Fe2����Ӧѡ��____��
A��KSCN��Һ����ˮ B�����ۺ�KSCN��ҺC��Ũ��ˮD������KMnO4��Һ
����ͬѧȡ560 mL(��״��)����Yͨ��������ˮ�У�����SO2��Br2��2H2O===2HBr��H2SO4��Ӧ��Ȼ���������BaCl2��Һ�����ʵ�������ø������4.66 g���ɴ���֪����Y��SO2���������Ϊ________��
[̽����]��������ʵ����SO2��������ķ�������ͬѧ��Ϊ����Y�л����ܺ���Q1��Q2�������壬����Q1���壬�ڱ�״���£��ܶ�Ϊ0.089 3 g��L��1��Ϊ�����������̽��ʵ��װ��(�����й�������ȫ��Ӧ)��
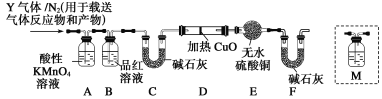
��3��װ��B���Լ���������________________________��
��4������Y�����е�Q2������������ɵ�______________(�û�ѧ����ʽ��ʾ)��
��5����֪ϴ��ƿM��ʢװ����ʯ��ˮ��Ϊȷ��Q2�Ĵ��ڣ�����װ��������ϴ��ƿM��________(�����)��
A��A֮ǰ B��A��B�� C��B��C�� D��C��D��
��6���������Y�к���Q1��Ԥ��ʵ������Ӧ��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��ͬѧչ����Ư����������(NaClO2)���о���
ʵ����. ��ȡNaClO2����
��֪��NaClO2������Һ���¶ȵ���38 ��ʱ�����ľ�����NaClO2��3H2O������38 ��ʱ�����ľ�����NaClO2������60 ��ʱNaClO2�ֽ��NaClO3��NaCl����������ͼ��ʾװ�ý���ʵ�顣
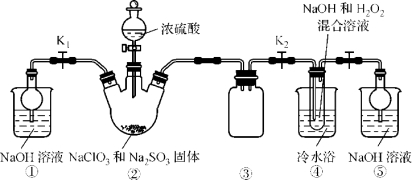
��1��װ������������ ��
��2��װ�����в���ClO2�Ļ�ѧ����ʽΪ ��װ�������Ʊ�NaClO2�Ļ�ѧ����ʽΪ ��
��3����װ������Ӧ�����Һ���NaClO2����IJ����������£�
����ѹ��55 �������ᾧ;�����ȹ������� ��������60 ������õ���Ʒ��
ʵ����. �ⶨij����������Ʒ�Ĵ���
�������ʵ�鷽����������ʵ�飺
��ȷ��ȡ��������������Ʒm g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ(��֪��ClO2-+4I-+4H+��2H2O+2I2+Cl-)�������û��Һ���250 mL������Һ��
����ȡ25.00 mL������Һ����ƿ�У��Ӽ��ε�����Һ����c mol��L-1 Na2S2O3��Һ�ζ������ζ��յ㡣�ظ�2�Σ����ƽ��ֵΪV mL(��֪��I2+2S2O32-��2I-+S4O62-)��
��4���ﵽ�ζ��յ�ʱ������Ϊ ��
��5������Ʒ��NaClO2����������Ϊ (�ú�m��c��V�Ĵ���ʽ��ʾ)��
��6���ڵζ�������ȷ���������£���ʵ���ý��ƫ�ߣ�ԭ�������ӷ���ʽ��ʾΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ��ѡ��3�����ʽṹ������] ��ѧ��Ϊһ�Ż�����Ȼ��ѧ���ڲ��Ͽ�ѧ��������ѧ����Դ��ѧ�������������Ҫ���á�
��1�����³��������Ʊ�ͭ���Ļ�ѧʽΪYBaCu3O7������1/3��Cu�Ժ�����Cu3+��ʽ���ڡ�Cu��Ԫ�����ڱ��е�λ��Ϊ____ ����̬Cu3+�ĺ�������Ų�ʽΪ_ _______��
��2�����Բ���������Ϳ�ѧ������Ӧ�ù㷺���о������������ɻ��������������δ�ɶԵ���ʱ����û�������д��ԡ����������ʺ���¼���Ŵ��ŷ�ԭ�ϵ�Ϊ____����ѡ����ĸ����
A��V2O5 | B��CrO2 | C��PbO | D��ZnO |
��3�����������ڿ�űҩ�����������о��еĽܳ����ף���Ϊ���ѧ��ŵ���������й��ˡ������صĽṹ��ʽ��ͼl��ʾ�������Ԫ�صĵ縺���ɴ�С��˳��Ϊ ��̼ԭ�ӵ��ӻ���ʽ��____ ��
��4������ȼ������������ȾС����Ϊδ��ʯ�͵������Դ���ɼ����ˮ�γɵ�����ȼ�����ṹ��ͼ2��ʾ��
�١���ȼ�����з��Ӽ���ڵ�2��������Ϊ ��
��H2O��VSEPRģ��Ϊ ���Ƚϼ��ǵĴ�С��H2O CH4������>����<������=������ԭ��Ϊ ��
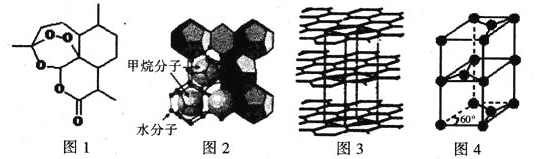
��5������ӵ���ڱ�Яʽ�����豸�Լ��綯���������ǵ�������ʾ��������Ӧ��ǰ�����õ�ظ�������Ϊʯī��ʯīΪ��״�ṹ����ͼ3�����侧���ṹ��ͼ4��ʾ���þ������� ��̼ԭ�ӡ���֪ʯī�IJ���Ϊapm��C-C����Ϊb pm������٤��������ֵΪNA����ʯī������ܶ�Ϊ g��cm-3(�г�����ʽ)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com