
下列叙述正确的是 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
A.将![]() 通入
通入![]() 溶液中至饱和,无沉淀产生;再通入
溶液中至饱和,无沉淀产生;再通入![]() ,产生沉淀
,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入![]() 固体,铜粉仍不溶解
固体,铜粉仍不溶解
C.向![]() 溶液中滴加氨水,产生白色沉淀;再加入
溶液中滴加氨水,产生白色沉淀;再加入![]() 溶液,沉淀消失
溶液,沉淀消失
D.纯锌与稀硫酸反应产生氨气的速率较慢;再加入少量![]() 固体,速率不改变
固体,速率不改变
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:阅读理解



| ||
| ||

查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省高三上学期12月月考理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是w.
A.25℃时,PH=13的1.0L Ba(OH)2溶液中含有的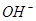 数目为0.2NA
数目为0.2NA
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D.标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与环境、工农业生产等密切相关,下列叙述正确的是.w.w.k.s.5.u.c.o.m
A.光化学烟雾与大量排放碳氢化合物和氮氧化合物有关
B.将草木灰和硫铵混合施用,肥效更高
C.棉花、蚕丝和锦纶的主要成分都是纤维素
D.为了防止中秋月饼等富脂食品氧化变质,延长保质期,可在包装袋中放入生石灰
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省辛集三中高二化学选修四期中试卷(带解析) 题型:单选题
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
下列叙述正确的是w w w.k s 5 u.c o m
| A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g) = 2HCl(g) |
| B.氢气和氯气反应生成2 mol氯化氢气体,反应的DH =" 183" kJ/mol |
| C.氢气和氯气反应生成2 mol氯化氢气体,反应的DH =-183 kJ/mol |
| D.氢气和氯气反应生成1 mol氯化氢气体,反应的DH =-183 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com