
(7分)X、Y、Z为短周期元素,在元素周期表中的位置如图所示。X、Z两种元素原子的质子数之和等于Y元素原子核外电子数。
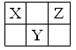
⑴写出元素的名称:X Y Z
⑵X元素位于第 周期 族。
⑶Z的单质与水反应的化学方程式为 。
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
(15分) 某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分)。[已知碱式碳酸镁Mgx(OH)y(CO3)z(x、y、z为正整数)加热能分解生成氧化镁、水和二氧化碳]
(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是_____________;A处干燥管盛放的药品是_____________,其作用是____________________________。
(2)指导老师在审阅设计方案后指出需要在E处进行改进,请你帮助该小组设计出改进方案:____________________________________。
(3)加热前需要进行的必要操作是__________________________________,其目的是____________________________________;对活塞的操作方法是:关闭活塞 ________,打开活塞________。
(4)通过什么现象能够说明碱式碳酸镁分解完全____________________________。
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其目的是________________________。
(6)实验测得数据如下:碱式碳酸镁样品22.6 g;反应前C装置的质量为87.6 g,反应后质量为89.4 g;反应前D装置的质量为74.7 g,反应后质量为83.5 g。请计算推导该碱式碳酸镁的化学式___________________________,该碱式碳酸镁受热分解的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012届山东省潍坊市三县市高三上学期期中联合考试化学试卷 题型:填空题
( 7分)X、Y、Z为三种常见短周期元素,它们位于同一周期,且原子序数依次增大,X的最高价氧化物对应的水化物为强碱,Y、Z的最高价氧化物对应的水化物均为强酸,W与Z同主族,且其原子序数相差18。请回答下列问题:
(1)Z的含氧酸中相对分子质量最小的是_____________________。(填化学式)
(2)X2Y与W2在水溶液中反应的离子方程式为_________________________________。
(3)下图装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图。装置(Ⅰ)的离子交换膜只允许X+通过。电池充电、放电的电池反应为:
当闭合K时,X及附近溶液变红色。下列说法正确的是____________________。
| A.闭合K时,X+从右到左通过离子交换膜 |
| B.闭合K时,负极反应为3XW-2e-=XW3+2X+ |
| C.闭合K时,X电极的电极反应为2Cl-2e-=Cl2↑ |
D.闭合K时,当有0.1mol X+通过离子交换膜,X电极 上析出标准状况下气体1 上析出标准状况下气体1 .12L .12L |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省、临川一中高三12月联考化学试卷(解析版) 题型:填空题
(共15分)(9分)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的元素名称为 ;五种元素的原子半径从小到大的顺序是(用元素符号表示) 。
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,用电子式表示A的形成过程 ,B的结构式 。
(3)硒(Se)是人体必须的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为 ,其最高价氧化物对应的水化物化学式为 。该族2~5周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是 (填字母代号)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1 c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
(4)一定条件下,M与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知。该反应生成lmol乙时放出536kJ热量,其热化学方程式为
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山西省晋中市高三第二次模拟考试(理综)化学部分 题型:实验题
(15分) 某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分)。[已知碱式碳酸镁Mgx(OH)y(CO3)z(x、y、z为正整数)加热能分解生成氧化镁、水和二氧化碳]

(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是_____________;A处干燥管盛放的药品是_____________,其作用是____________________________。
(2)指导老师在审阅设计方案后指出需要在E处进行改进,请你帮助该小组设计出改进方案:____________________________________。
(3)加热前需要进行的必要操作是__________________________________,其目的是____________________________________;对活塞的操作方法是:关闭活塞 ________,打开活塞________。
(4)通过什么现象能够说明碱式碳酸镁分解完全____________________________。
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其目的是________________________。
(6)实验测得数据如下:碱式碳酸镁样品22.6 g;反应前C装置的质量为87.6 g,反应后质量为89.4 g;反应前D装置的质量为74.7 g,反应后质量为83.5 g。请计算推导该碱式碳酸镁的化学式___________________________,该碱式碳酸镁受热分解的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com