
 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为CH3COOCH2CH3.
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为CH3COOCH2CH3. 是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成.实验室现以食品防腐剂[主要成分为苯甲酸钠(
是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成.实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯.已知:
)]、甲醇为原料制备苯甲酸甲酯.已知:| 熔点℃ | 沸点℃ | 水溶性 | |
| 甲醇 | -97.8 | 64.7 | 易溶 |
| 苯甲酸 (一元弱酸) | 122.4 | 249.3 | 常温:0.17g 100℃:6.8g |
| 苯甲酸甲酯 | -12.3 | 198 | 难溶 |


 .
.分析 Ⅰ、(1)有机物只含有碳、氢、氧三种元素,知含碳54.55%,含氢9.10%,以及相对分子质量为88,要计算出含有的碳氢原子个数,再用相对分子质量减去碳、氢元素的相对质量和,再结合氧原子的相对原子质量是16,可计算出氧原子数目,确定有机物的分子式,再结合经红外光谱分析其中只含C-H键和 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,可知此有机物是酯,写出满足有条件的有机物A结构简式;
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,可知此有机物是酯,写出满足有条件的有机物A结构简式;
(2)有机物A为酯,根据对应的羧酸和醇写出相应的化学方程式.
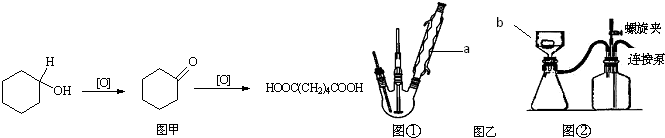
Ⅱ、(1)根据酯化反应原理合成苯甲酸甲酯,整个流程包括制备、分离、精练三个阶段,其中制备过程应结合反应物甲醇的沸点64.7℃控制反应温度,以防止甲醇挥发,不易提高产率,分离过程可根据酯在水溶液里溶解度小,混合物静置后会分层的现象选择分离方法,所得粗产品是相互混溶的有机混合物,可根据沸点差异,选择分离方式;
(2)在进行第②步操作前所得反应混合物中含有过量未反应的甲醇,可通过②加热除去,有利于粗产品的分离提纯;
(3)化反应的原理选择制备装置,考虑到反应温度较低及防反应物和生成物挥发,可借助排除法在A、B、C、D四套装置中选择最合理的装置;
(4)苯甲酸甲酯的同分异构体满足①为芳香化合物说明有苯环,②含有醛基,③能与金属Na反应说明有羟基,依据这三个条件可写出符合条件的同分异构体.
解答 解:Ⅰ、(1)通过元素分析知含碳54.55%,含氢9.10%.质谱分析其相对分子质量为88,则该有机物分子中碳与氢原 子的个数分别是 $\frac{88×0.5455}{12}$=4、$\frac{88×0.0910}{1}$=8,则分子氧原子的个数是$\frac{88-12×4-1×8}{16}$=2,即该有机物的化学式为C4H8O2,经红外光谱分析其中只含C-H键和
子的个数分别是 $\frac{88×0.5455}{12}$=4、$\frac{88×0.0910}{1}$=8,则分子氧原子的个数是$\frac{88-12×4-1×8}{16}$=2,即该有机物的化学式为C4H8O2,经红外光谱分析其中只含C-H键和 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A应该是酯类,结构简式为CH3COOCH2CH3,故答案为:CH3COOCH2CH3;
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A应该是酯类,结构简式为CH3COOCH2CH3,故答案为:CH3COOCH2CH3;
(2)A是乙酸乙酯,实验室用乙酸与乙醇在浓硫酸的作用下发生酯化反应得到,该反应的化学方程式为CH3COOH+HOCH2CH3$\stackrel{浓硫酸}{?}$CH3COOCH2CH3+H2O,故答案为:CH3COOH+HOCH2CH3$\stackrel{浓硫酸}{?}$CH3COOCH2CH3+H2O;Ⅱ、(1)由于甲醇的沸点是64.7℃,温度过高甲醇易挥发,所以加热温度不能超过64.7℃.冷却后得到粗产品,而苯甲酸甲酯不溶于水,所以分离得到粗产品的方法是分液.粗产品苯甲酸甲酯中含有苯甲酸,二者的沸点相差较大,因此操作④应该是蒸馏,故答案为:64.7;分液;蒸馏;
(2)由于甲醇的沸点较低,操作②加热的目的是蒸出过量的甲醇,故答案为:蒸出过量的甲醇;
(3)由于反应中需要控制温度,所以需要温度计,CD不正确.又因为水浴加热,容易控制温度,且受热均匀,应选择B装置,故答案为:B;
(4)①为芳香化合物,说明含有苯环.②含有醛基,③能与金属Na反应,说明还含有羟基,所以可能的结构简式为 ,故答案为:
,故答案为: .
.
点评 本题以酯化反应的原理设计制备苯甲酸甲酯的实验操作,涉及反应原理,流程分析与评价,以及有机物的同分异构体的书写等,重视基础测试,难度不大,通过训练达到复习双基的目的.


科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO2含有NA个CO2分子 | B. | 0.1NA个H2SO4分子的质量为9.8克 | ||
| C. | 10gCaCO3含有NA个C原子 | D. | 2molCl2含有2NA个Cl原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压同体积的气体单质所含原子个数相等 | |
| B. | 常温常压下,11.2LO2所含的氧原子数为NA | |
| C. | 摩尔是沟通宏观和微观的桥梁 | |
| D. | 大规模海水淡化采用蒸馏法 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
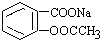 转变为
转变为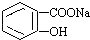 的方法是( )
的方法是( )| A. | 与足量Na0H溶液共热后,再通入CO2 | |
| B. | 溶液加热,通入足量的SO2 | |
| C. | 与稀硫酸共热后,加入足量Na0H溶液 | |
| D. | 足量稀硫酸共热后,加入足量NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在25℃,101KPa的条件下,将共8L的CO和O2的混合气体通入一个带可自由移动活塞容积可变但压强不变的密闭容器中(如图所示),用电火花点燃充分反应后恢复至原来的条件,测得气体的密度变为原来的$\frac{4}{3}$,求
在25℃,101KPa的条件下,将共8L的CO和O2的混合气体通入一个带可自由移动活塞容积可变但压强不变的密闭容器中(如图所示),用电火花点燃充分反应后恢复至原来的条件,测得气体的密度变为原来的$\frac{4}{3}$,求查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com