
| A. | 浓度均为0.1mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | pH相同的盐酸和硫酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH相等,则m>n | |
| C. | 常温下,0.1mol•L-1某一元酸HA在水中有0.1%发生电离,则该温度下HA的电离常数约为10-7 | |
| D. | 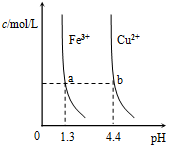 某温度下,Fe(OH)3,Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图.由图可知:Ksp[Fe(OH)3]<K[Cu(OH)2] |
分析 A.浓度均为0.1mol•L-1的小苏打溶液与烧碱溶液等体积混合前后反应生成碳酸钠溶液,溶液中存在电荷守恒;
B.盐酸和硫酸都是强酸,开始 氢离子浓度相同,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH相等,则稀释倍数相同;
C.电离度及离子的浓度计算电离平衡常数;
D.图象找出可用来比较Fe(OH)3与Cu(OH)2溶度积常数点,进行比较.
解答 解:A.浓度均为0.1mol•L-1的小苏打溶液与烧碱溶液等体积混合前后反应生成碳酸钠溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),
故A正确;
B.pH相同的盐酸和硫酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH相等,则m=n,故B错误;
C.由HA═H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=1×10-7,故C正确;
D.由b、c两点对应数据可比较出KSP[Fe(OH)3]与KSP[Cu(OH)2]的大小,KSP[Fe(OH)3]=c(Fe3+)•(OH-)3=c(Fe3+)•(10-12.7)3,
KSP[Cu(OH)2]=c(Cu2+)•(OH-)2=c(Cu2+)•(10-9.6)2,因c(Fe3+)=c(Cu2+),故KSP[Fe(OH)3]<KSP[Cu(OH)2],故D正确;
故选B.
点评 本题综合考查沉淀溶解平衡、溶度积、pH、弱电解质电离平衡等,对图象中的数据进行定量或定性处理,找出数据(或坐标点)之间存在的相互关系,该题型重在考查综合能力,如分析比较、理解转换等,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 除去乙酸乙酯中的少量乙酸:加入饱和Na2CO3溶液,分液 | |
| B. | 除去Fe2O3中的少量Al2O3:加入过量NaOH溶液,过滤,洗涤干燥 | |
| C. | 除去氯气中的少量氯化氢:通过盛有饱和食盐水溶液的洗气瓶 | |
| D. | 提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
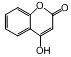 是一种医药中间体,常用来制备抗凝血药,有关该有机物的说法正确的是( )
是一种医药中间体,常用来制备抗凝血药,有关该有机物的说法正确的是( )| A. | 该有机物分子中含有4种官能团 | |
| B. | lmol该有机物最多能与5mol氢气发生加成反应 | |
| C. | 该有机物能与氯化铁溶液发生显色反应 | |
| D. | 该有机物能与氧氧化钠溶液反应,1mol有机物最多消耗2mol氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验次数 | 样品溶液体积(mL) | 滴定消耗0.100mol/L碘溶液体积(mL) |
| 1 | 20.00 | 9.80 |
| 2 | 20.00 | 10.70 |
| 3 | 20.00 | 9.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

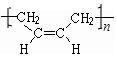 .
.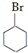 +NaOH$\stackrel{加热}{→}$
+NaOH$\stackrel{加热}{→}$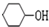 +NaBr.
+NaBr.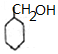 制备的合成路线.
制备的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2F2+2H2O═4HF+O2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com